Nicewicz fotoredox katalizátorok Anti-Markovnikhoz
Bevezetés
Míg a Markovnyikov-alkénreaktivitás nagyon jól kidolgozott és általánosan hasznosítják az alap- és kutatási vegyszerek szintézisében, az anti-Markovnyikov-szelektív adduktokhoz való katalitikus hozzáférés sokkal kevésbé fejlett törekvés. David Nicewicz professzorral együttműködve a Sigma-Aldrich büszke arra, hogy olyan fotoexcitabilis akridíniumsók választékát kínálja, amelyek teljes anti-Markovnyikov-szelektivitással képesek elősegíteni a különböző olefin-hidrofunkcionalizációkat.
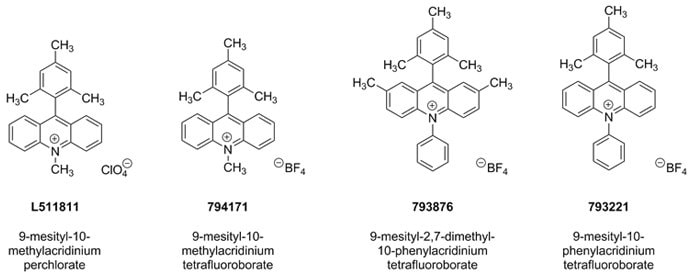
A 9-mesityl-10-metilakridínium-perklorát kationos szerves oxidálószert eredetileg Shunichi Fukuzimi és munkatársai tervezték.1 Bevezetése óta a Nicewicz-csoport bizonyította ennek az anyagnak és a kapcsolódó fotoredox-katalizátoroknak a széleskörű felhasználhatóságát (794171, 793876, 793221), ha elsősorban tioltartalmú hidrogénatom-átvivő társkatalizátorokkal együtt alkalmazzák.2 alkén-kation gyökös intermedierek keletkezése révén,3 ez az egyedülálló fotoredox katalizátor rendszer hidrofunkcionalizálást tesz lehetővé az aktivált és nem aktivált alkének széles skálájának hidroforilálását különféle nukleofilekkel, például karbonsavakkal, aminokkal, ásványi savakkal, valamint propargil- és allil-alkoholokkal.2-3
1. ábra.Propargil-és-allilalkoholok
Előnyei
- Fémmentes, látható fény által közvetített katalizátor
- Lég- és nedvességstabil
- Enyhe reakciókörülmények
- Anti-Markovnyikov-szelektivitás
- Felsőbbrendű oxidáló képesség a Ru- és Ir-polipiridil-fotoxidánsokhoz képest
- Az akridíniumsók egyszerű gerjesztése LED-es reflektorokkal
Reprezentatív alkalmazások
Hidroéteresítés
Teljes regioszelektivitást figyeltek meg több mint 10 példában az alkenolok közvetlen intramolekuláris anti-Markovnikov hidroéteresítésére, amikor 9-mezitil-10-metilakridínium-perklorátot használtak 2-fenil-malononitrilt hidrogénatom-donorként.4

Hidroaminálás
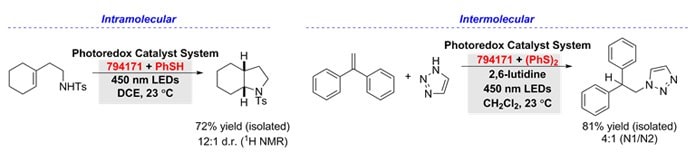
Az alkének hidroaminálása elérhető 9-mesityl-10-metilakridínium-tetrafluoroborát (794171) használatával, teljes anti-Markovnyikov-szelektivitással, tioltartalmú társkatalizátor jelenlétében. A tiofenollal telítetlen aminok intramolekuláris hidroaminálása számos nitrogéntartalmú heterociklushoz biztosított hozzáférést.5 Továbbá alifás alkének, α- és β-szubsztituált sztirolok és heterociklusos aminok intermolekuláris hidroaminálását sikerült elérni difenil-diszulfiddal.6
2. ábra.Difenil-diszulfid
Hidrotrifluor-metilezés
Ezzel a fotoredox katalizátor rendszerrel különféle trifluor-metilezett termékeket nyertek. A Langlois-reagens (743232) egyelektronos oxidációja 9-mesityl-10-metilakridínium-tetrafluoroborát (794171) és egy tioltartalmú társkatalizátor (metiltioszalicilát vagy tiofenol) segítségével sztirolok és nem aktivált alifás alkének hidrotrifluor-metilálását eredményezi anti-Markovnyikov-szelektivitással. Nicewicz és munkatársai 20 példát szolgáltattak 25-74%-os hozammal.7

3. ábra.Sztirolok hidrotrifluor-metilálása
Hidroacetoxilezés
Sztirolok, zománcok és triszubsztituált alifás aminok anti-Markovnyikov-szelektív hidroacetoxilezése lehetséges egy sor karbonsavval, ha 9-mezitil-10-metilakridínium-tetrafluoroborátot (794171) nátrium-benzol-szulfináttal vagy tiofenollal kombinálva. Tizenhét reakcióban 29-99% közötti hozamot mutattunk ki.8

4. ábra.Nátrium-benzol-szulfinát
Ásványi savak addíciója
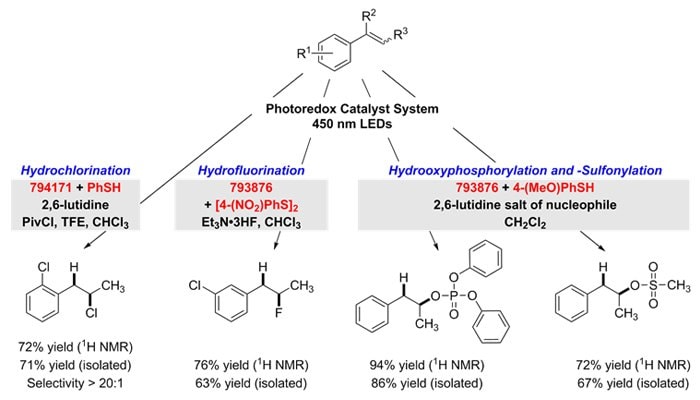
Elérhető erős Brønsted-savak anti-Markovnyikov-addíciója alkénekhez teljes regioszelektivitással ezekkel a fotokatalizátorokkal. A hidroklórozáshoz 9-mesityl-10-metilakridínium-tetrafluoroborátot (794171) használunk tiofenollal az addukt előállításához. A hidrofluorozás, a hidrooxifoszforilálás és a hidrooxiszulfonilálás mindegyike a 9-mezitil-2,7-dimetil-10-fenilakridínium-tetrafluoroborát (793876) és a hidrogénatom-donorok, a 4-nitrofenil-diszulfid vagy a 4-metoxi-tiofenol alkalmazásával történik. Itt a 2,6-lutidinium-sók bevonása a nukleofil couterion révén a legjobb reaktivitást biztosította.9
5. ábra.Nukleofil-kutérium
Amiidok intramolekuláris hidrofunkcikalizációja
A telítetlen allyil-amidok és tioamidok anti-Markovnyikov intramolekuláris ciklizációja a kapott 2-oxazolinokat, illetve 2-tiazolinokat eredményezi. Ezek az átalakítások egy fotoredox katalizátorrendszert használnak, amely 9-mezitil-10-metilakridinium-tetrafluoroborátot (794171) tartalmaz difenil-diszulfiddal kombinálva. 17 példán keresztül 59-82%-os hozamot figyeltek meg.10

6. ábra.Kombináció a difenil-diszulfiddal
Hidrodekarboxilezés
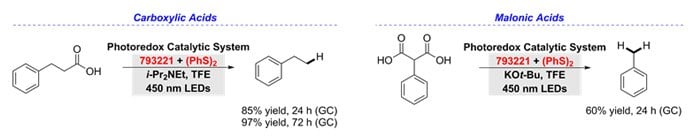
A karbonsavak és malonsavak anti-Markovnyikov-hidrodekarboxilezése 9-mezitil-10-fenilakridínium-tetrafluoroboráttal (793221) és difenil-diszulfiddal történik. A dekarboxilezési reakcióhoz bázis és poláros alkoholos oldószer, trifluoretanol bevonása szükséges a jó hozam és a jó hatótávolság elérése érdekében. Tizennyolc példát vettünk fel az elsődleges, másodlagos és harmadlagos karbonsavak hidrodekarboxilezésének bemutatására.11
7. ábra.Tercier-karbonsavak
Poláris radikális keresztező cikloaddíciók
A poláris radikális keresztező cikloaddíciók egy tandem addíciós-ciklizációs sorozatban a fotoredox katalizátor rendszer variációit használják az alkénekből a következő termékek előállítására: g-butilaktonok (α,β-telítetlen karbonsavakkal),12 tetrahidrofuránok (allil-alkoholokkal),13 g-laktámok (telítetlen amidokkal) és pirrolidinek (telítetlen aminokkal).14
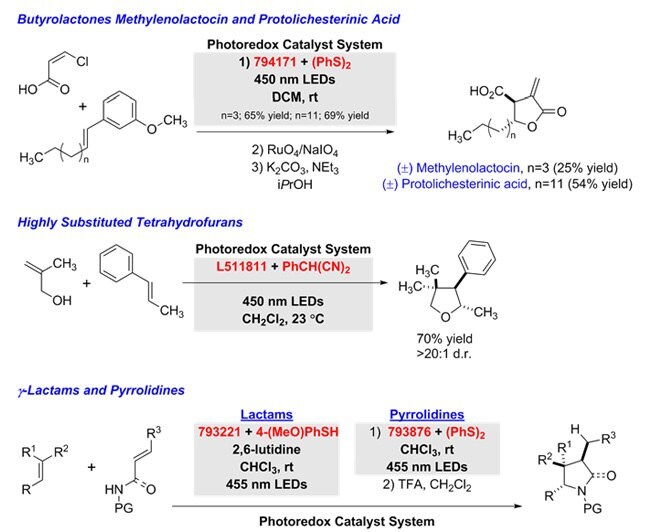
8. ábra.Telítetlen-aminok
Fotooxigenálás
Nicewicz beszámolóit megelőzően Griesbeck és Cho 9-mesityl-10-metilakridínium-perklorátot használtak O2 jelenlétében, mint látható fény által közvetített katalizátort II. típusú és elektronátvivő fotooxigenálási reakciókhoz.15
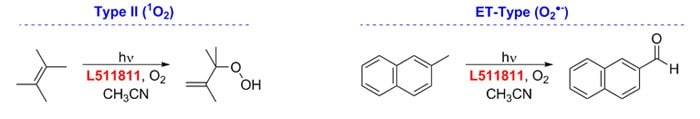
9. ábra.Fotoxigenizációs reakciók
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?