Fontos dokumentumok
SML1135
MG-132(R)
≥95% (HPLC)
Szinonimák:
Z-L-Leu-D-Leu-L-Leu-al
About This Item
Javasolt termékek
termékcsalád
SAFC Hitech®
Minőségi szint
Teszt
≥95% (HPLC)
form
powder
oldhatóság
DMSO: soluble
tárolási hőmérséklet
−20°C
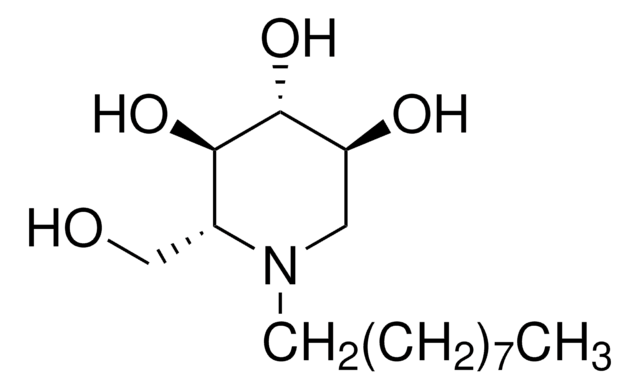
SMILES string
O=C(N[C@H](CC(C)C)C(N[C@H](C=O)CC(C)C)=O)[C@H](CC(C)C)NC(OCC1=CC=CC=C1)=O
InChI
1S/C26H41N3O5/c1-17(2)12-21(15-30)27-24(31)22(13-18(3)4)28-25(32)23(14-19(5)6)29-26(33)34-16-20-10-8-7-9-11-20/h7-11,15,17-19,21-23H,12-14,16H2,1-6H3,(H,27,31)(H,28,32)(H,29,33)/t21-,22+,23-/m0/s1
Nemzetközi kémiai azonosító kulcs
TZYWCYJVHRLUCT-ZRBLBEILSA-N
Géninformáció
human ... CTSB(1508) , NFKB1(4790) , PSMA1(5682)
Related Categories
Biokémiai/fiziológiai hatások
Jogi információk
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Az ügyfelek ezeket is megtekintették
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással