RT-PCR hibaelhárítás
Az oldalon
- Hibaelhárítási protokoll kidolgozása
- Oligótervezés optimalizálása
- Oligótervezés optimalizálása br>
- PCR-tesztek optimalizálása
- RT-PCR és qPCR-tesztek tervezése
- PCR és qPCR-tesztek tervezése
- RNS vagy DNS sablon minősége
- Assay PCR program
- Az Assay PCR program
- Thermo Cycler meghibásodás
- Hibaelhárítási példák: Diagnosztikai eszközök
- Dissociációs / olvadási görbék
- Hibaelhárítás RT-PCR esettanulmányok
- Összefoglaló - PCR hibaelhárítás ellenőrzőlista
PCR vagy RT-PCR hibaelhárítási protokoll kidolgozása
Hiba és/vagy problémák lehetséges forrásai Kezelői hiba
A kezelői hiba számos lehetőséggel járhat. E hibák forrásai gyakran azonosítatlanok maradnak. Minden hibaelhárítási eljárás első lépése a protokoll ellenőrzése és a kísérlet megismétlése. Fontos a protokoll ellenőrzése (lásd Appendix A, Protocols, ebben az útmutatóban) és egy tapasztalt molekuláris biológus megkérése a kísérleti terv felülvizsgálatára. A posztdoktori munkatárs elrettentő története, aki több sikertelen PCR-t is lefuttatott, mielőtt rájött, hogy a dNTP-k hiányoznak a PCR master mix emlékeztet arra, hogy még a legjobb túlhajszolt tudósok is ki vannak téve egyszerű hibáknak.
Master Mix
A reakciókomponensek master mix keverékével kapcsolatos hibák vagy problémák az összes minta és pozitív kontroll esetében az amplifikáció katasztrofális kudarcának forrása lehet. A kísérlet megismétlése előtt ellenőrizze az összes komponenst és azok koncentrációját. Ha új reagens-tételt használunk, hasznos elővigyázatosság, ha az újat a régivel összevetjük, mielőtt nagyobb kísérletsorozatba kezdünk.
A mesterkeverék-termékek váltásakor fontos felismerni, hogy egyes próbák különösen érzékenyek a pufferösszetétel/barnítási hőmérséklet (Ta)/primer koncentráció kombinációkra. Ezek bármelyikének megváltoztatása eltérő teljesítményt eredményezhet. Ezért a radikális változtatások előtt ellenőrizze az összes próbát a kiválasztott mesterkeverékekben és az összes kívánt eszközön. Az egyes mesterkeverékekhez mellékelt utasításokat is feltétlenül át kell nézni, mivel azok meghatározzák az adott enzimre, Hot Start mechanizmusra és pufferkomponensekre optimalizált ajánlott feltételeket.
A jó laboratóriumi gyakorlat szerint biztosítani kell, hogy minden együtt futtatandó mintához elegendő reakciómester keveréket készítsenek. Gondoskodjon arról, hogy az összes komponenst gondosan felolvassa és jól összekeverje, és hogy a kísérleti mesterkeveréket nagyon jól összekeverje, mielőtt aliquotálja a mintákhoz. Ez különösen fontos néhány 2× puffer, például a KiCqStart® esetében, amelyek viszkózusabbak, mint a normál PCR-pufferek.
Oligooptimalizálás
Az oligók problémákat okozhatnak, ha; helytelen szekvenciájúak vagy rosszul vannak megtervezve, nem optimális koncentrációban, nem optimális Ta értéken futnak, vagy nem megfelelően vannak jelölve vagy elfojtva (szondák esetében). Az oligók számára nem optimális körülmények között vagy rossz tervezéssel végzett vizsgálat eredményezhet bizonyos adatokat, azonban ez nem feltétlenül tükrözi a vizsgált valódi biológiát. A liofilizált oligók átvételekor kritikus fontosságú, hogy:
- Ellenőrizze a szekvenciát
- Győződjön meg arról, hogy az összes DNS-t felhasználás előtt reszuszpendálják
- Ellenőrizze, hogy az oldat az elvárt koncentrációjú
Az oligók reszuszpendálása az oligók 5 percig tartó 90 °C-ra történő melegítésével, majd alapos keveréssel. A fagyasztás-felolvasztás ismételt ciklusai is befolyásolhatják az oligók teljesítményét, ezért minden oligót készletkoncentrációban (általában 100 μM) aliquotálni kell, és -20 °C-on, illetve hosszú távon -80 °C-on kell tárolni.
A hibakeresési fázisban kritikus fontosságú annak ellenőrzése, hogy a helyes szekvenciát rendeltük-e meg, visszatérve a célszekvenciához, és megerősítve, hogy az oligószekvenciák valóban jelen vannak. Győződjön meg arról, hogy az oligók minősége megfelelő volt, az oligók szállítójával való kapcsolatfelvétel útján. Mérje meg az oligo munkakoncentrációját, és vizuálisan vizsgálja meg a fluoreszcens molekulákat annak megerősítése érdekében, hogy azok jelöltek-e. Az amplifikáció ellenőrzése érdekében tesztelje a szondás próbák primereit SYBR® Green I qPCR keverékben. Fontolja meg a primerkoncentrációk vagy a Ta optimalizálását (lásd Assay optimalizálás és validálás). Ha először használ egy szondát, gyűjtsön fluoreszcens adatokat a lehető legtöbb lehetséges hullámhosszon, hogy megfigyelhető legyen a jel esetleges szivárgása a csatornák között, és a jelölési hibák felismerhetők legyenek.
Inadekvát PCR optimalizálás
Az assay-optimalizálás hatását a Assay-optimalizálás és validálás. Ha egy assay nem működik vagy szuboptimálisan teljesít, de a tervezésben vagy a működési eljárásokban nincsenek hibák, akkor a kísérleti feltételek optimalizálása előnyös lehet. A hibaelhárítás során tesztelje a primereket 100 nM, 500 nM és 900 nM végső koncentrációban és/vagy Ta 55 °C és 70 °C közötti hőmérsékleten (hőmérsékleti gradiens használatával), hogy megállapítsa, hogy az assay további optimalizálással javul-e.
RT-PCR és qPCR Assay tervezése
.Az Assay-tervezés a PCR/qPCR/dPCR Assay Design. Egy assay hibaelhárításakor győződjön meg arról, hogy a tervezést ellenőrizték. Ellenőrizze, hogy a PCR/qPCR-primer és az amplikon pozíciója összhangban van-e az RT-primer protokollal. Győződjön meg például arról, hogy az oligo-dT primerelés után készített cDNS-en alkalmazott próbák a transzkript 3' irányába helyezkednek el. Győződjön meg arról, hogy a szekvenciainformáció megbízható, és hogy a megfelelő splice-változatokat és SNP-ket figyelembe vették.

11.1A. ábra.A vizsgálatnak szokatlan amplifikációs profilja van, az alapvonal jelentős driftjével.

11.1B. ábra.A vizsgálatba bevont szonda szekvenciáját beírtuk az mfold folding prediction szoftverbe. Egyértelmű, hogy a szonda stabilan összehajtott szerkezetet vehet fel oldatban, és ez valószínűleg a megfigyelt problémát eredményezi.
RNS vagy DNS sablon minősége
A sablon minőségének a vizsgálat teljesítményére gyakorolt hatását az Mintatisztítás és minőségértékelés. A minta minősége magában foglalja a mennyiség, az integritás és az inhibitorok jelenlétének figyelembevételét. Kritikus fontos, hogy az RNS minősége illeszkedjen a legmegfelelőbb RT-primer protokollhoz (lásd Reverse Transcription), és hogy a lehető legjobb minőségű templát használjuk. Hasonlóképpen, az RT-reakciókhoz hozzáadott RNS mennyiségének a protokoll keretein belül kell lennie, és sok esetben ennek minden reakció esetében azonosnak kell lennie. A ReadyScript® figyelemre méltó kivétel ez alól az irányelv alól, mivel ennek a reagensnek és protokollnak az elfogadása lineáris cDNS-koncentrációt eredményez, amely arányos a bemeneti RNS mennyiségével. Olyan minta hibaelhárításakor, amely a vártnál magasabb Cq, -t eredményez, futtassa le a SPUD-tesztet, vagy hígítsa a mintát 1:5 vagy 1:10 hígítási sorozaton keresztül, és ismételje meg a tesztet (11.2. ábra) az inhibitorokat tartalmazó minták azonosítása érdekében.


11.2. ábra.Egy DNS-templát 10-szeres sorozathígításának amplifikációja. A replikátumok pontosak, de a ΔCq nem következetes, a hígítások növekedésével csökken. Az adatok a templát nélküli kontrollban (NTC) is pozitív jelet mutatnak, ami szennyeződésre vagy primer dimer képződésre utal, és hogy a 105 példánynál kisebb hígítások az NTC-vel azonos adatokat mutatnak.
A sablonok mennyisége szintén fontos szempont. Ha túl sok vagy túl kevés templátot teszünk a PCR-be, az sikertelen reakciókat és rendellenesnek tűnő qPCR-amplifikációs ábrákat eredményez. A 11.3A ábra egy olyan reakciót mutat, amely 10-szeres sorozathígítású mesterséges oligo templátot tartalmaz. Az alacsonyabb hígítások túlságosan koncentráltak ahhoz, hogy a reakció hatékony legyen, vagy hogy a műszer hatékonyan tudja feldolgozni az alapvonal-adatokat (11.3B ábra), ami abnormális amplifikációs plotokat és megbízhatatlan adatokat eredményez.

11.3. ábra. A)Egy mesterséges templát 10-szeres sorozathígításának amplifikálása specifikus primerekkel és FAM-jelölt szondával. A Cq nagyon alacsony a koncentrált minták esetében, az amplifikációs grafikonok nem szabályos távolságban vannak és rendellenesek. B) Ezeknek az amplifikációs plotoknak a nyers adatait mutatja. A legnagyobb koncentrációjú targetet tartalmazó reakciókban a háttérfluoreszcencia is jelentősen magasabb, és a reakción keresztül minimális a fluoreszcencia hozama.
Assay PCR program
A PCR-ciklikus körülményeknek alkalmasnak kell lenniük mind a kísérlethez, mind a reagensekhez (pl., lásd Master Mix). Az alapértelmezett műszerbeállítások elfogadása ellenőrzés nélkül nem tanácsos.
Thermal Cycler meghibásodás
A műszer hibái alattomosan kezdődhetnek, és ezért nehéz lehet diagnosztizálni őket. A drága javítási költségek megelőzése érdekében gondoskodjon arról, hogy a műszerek minden kezelője teljes körűen képzett és kezdetben felügyelt legyen. Egyes műszerhibák katasztrofális meghibásodásokat okoznak, amelyek nem eredményeznek amplifikációs vagy fluoreszcens adatokat, míg mások torzítják az adatokat, vagy nem egyenletes módon kezelik a mintákat, mesterséges különbségeket létrehozva az azonos biológiai minták között. A hibaelhárításhoz felbecsülhetetlen értékű a kontrollminták használata kontrollvizsgálatokkal. Ha műszerhiba gyanúja merül fel, megbízható, optimalizált próbát kell futtatni minden furatban. Ez az egyenletesség-ellenőrzés feltárja a műszer egyes régióira jellemző problémákat, valamint a különálló vizsgálati és műszerproblémákat.
A diagnosztikai eszközök használatát bemutató PCR hibaelhárítási példák
A jól megtervezett PCR lefuttatása után számos diagnosztikai eszköz áll rendelkezésre a hibaelhárításhoz:
- Kontrollminták és próbák
- Endpont gél/SYBR Green I festékreagens
- li>Amplifikációs plotok (ismétlések és amplifikációs plotprofil ellenőrzése)
- Standard görbék (gradiens és R2)/hígítási sorozat
- Melting/Dissociation Plots (SYBR Green I festék, Molecular Beacons, Scorpions® Probes)
- Raw data/multicomponent views
Kontroll minták/reakciók
A kontrollok használata erősen ajánlott. Egy sikertelen próba hibaelhárítása szinte lehetetlen a megfelelő kontrollkészletből származó információk nélkül.

11.4. ábra. A)A hígítatlan templát nem amplifikálódik, míg a hígítások javítják az amplifikáció hatékonyságát. B) 0,3%-os BSA hozzáadása a qPCR-keverékhez támogatja a hígítatlan templátból történő amplifikációt.
Egy teljesen sikertelen vizsgálat kivizsgálása nehéz lehet, mert kevés információ áll rendelkezésre a hibaelhárításhoz. Mivel sok assay meghibásodás valamilyen katasztrofális hiba eredménye, az első ellenőrzésnek a kísérlet beállításának ellenőrzését, majd a PCR megismétlését kell elvégezni. Ha ez nem sikerül, a hibaelhárítás a kísérlet minden egyes komponensére vonatkozó információtól függ (11-5. ábra).

11.5. ábra.A PCR alapvető hibaelhárítási folyamata.
Ha egy qPCR-kísérlet teljesen sikertelen, az első lépés az assay tervezésének, az oligoszekvenciáknak és az oligógyártó QC-adatainak ellenőrzése. Bár a próba esetleg sikertelen volt, a qPCR multikomponens/nyers adatok további információkkal szolgálhatnak. A 11.6A ábra két olyan próba nyersadat-diagramját mutatja, amelyek 6-FAM™ vagy HEX™ (VIC®) jelölésű szondát tartalmaznak. Bár mindkét próba amplifikációt mutat, a HEX jel körülbelül fele a FAM jelnek. Mivel ez egy eredendően gyengébb festék, ez normális megfigyelés. Az agarózgél-elemzés (11.6B ábra) azt mutatja, hogy mindkét reakció hasonló termékkoncentrációt eredményez, ami alátámasztja azt a megfigyelést, hogy a qPCR Cq értékek hasonlóak.

11.6. ábra. A)Egy FAM és egy HEX-jelzett szondát tartalmazó duplex próba nyers adatai. A FAM szonda természetesen nagyobb fluoreszcenciát ad. B) Az agarózgél, amely azt mutatja, hogy minden reakcióban azonos mennyiségű termék keletkezett, és megerősíti a qPCR Cq megfigyelést.
A nyers adatok vizsgálata hasznos ellenőrzés annak ellenőrzésére, hogy a szonda helyesen van-e jelölve, és hogy hozzáadták-e a reakcióhoz. A 11.7. ábra mutatja a három célpont amplifikációjának nyers adatait egy triplex kísérletben. Az egyes célpontokra specifikus szondák FAM, HEX és TAMRA jelöléssel vannak ellátva. A HEX és a TAMRA szondák alacsony hátteret és hatékony amplifikációt mutatnak, a FAM jel azonban a kísérlet során folyamatosan magas, és nincs nyoma amplifikációnak. Ez összhangban van a reakcióban lévő túl magas szondakoncentrációval vagy a szonda hibájával, ami miatt a jel nem csillapodik kezdetben. Ilyen esetekben ellenőrizni kell a szonda koncentrációját és a próbatervet, biztosítva, hogy a szonda kompatibilis jelölővel és fojtószerrel rendelkezzen, és szükség esetén új szondát kell tesztelni.
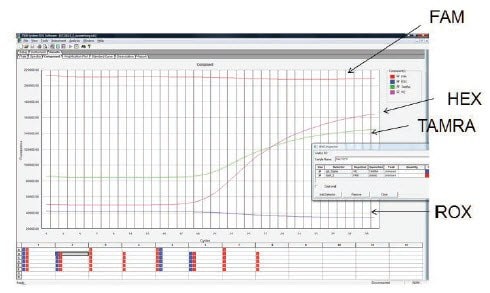
11.7. ábra.A triplex reakciót három célpont kimutatására használták FAM, HEX és TAMRA jelölésű szondák segítségével. A HEX és a TAMRA szondák a céltárgyakból amplifikációt eredményeztek, de a FAM szonda nem mutatott amplifikációt. A nyers adatok vizsgálata azt mutatta, hogy a háttér-fluoreszcencia kivételesen magas volt, és a reakció során nem volt megfigyelhető különbség. Ez összhangban van azzal, hogy a reakcióban túl magas volt a szondakoncentráció, vagy hibás szondát használtak, amelynek nem volt megfelelő a csillapítása.
Ha az eredeti kísérlet a szondás kimutatásra támaszkodott, a vizsgálatot meg kell ismételni SYBR Green I reagensekkel, beleértve egy pozitív és egy negatív kontrollt (de nem értékes mintákat). Alternatívaként a sikertelen reakció termékeit etídium-bromiddal festett agarózgélen is ellenőrizhetjük. A SYBR Green I megközelítés alkalmazása a kísérlet megismétlésére azért előnyösebb, mert így elkerülhető a szennyeződés kockázata, és egy ismételt kísérletet biztosít a kezdeti sikertelenség ellenőrzésére. Ha a SYBR Green I kísérlet adatot szolgáltat, lehetséges, hogy az eredeti szonda hibája technikai hiba vagy a szonda hibája miatt következett be. A kísérleti hiba vagy a szonda hibája közötti különbségtételhez ismételje meg a szondás kísérletet; ha a reakció ismét sikertelen, cserélje ki a szondát. Ez a megközelítés alkalmazható olyan reakciók vizsgálatára, amelyek gyenge adatokat szolgáltatnak. A 11.8. ábrán látható példában a szondás reakció nem volt optimális, és a SYBR Green I használatával lefuttatott reakcióval összehasonlítva látható, hogy a szonda jele nem tükrözi a kísérletet. Ilyen esetekben az assay tervét ellenőrizni kell, és új szondát kell tesztelni.

11.8. ábra.Azonos reakciókat futtattunk, amelyek vagy qPCR-szondát vagy SYBR Green I festéket tartalmaztak (a jelzetteknek megfelelően). A SYBR Green I reakció körülbelül tizenegy ciklussal érzékenyebb volt, és sokkal nagyobb végponti fluoreszcenciát eredményezett. Ez a szonda hibájára vagy a szondatervezéssel kapcsolatos problémára utal (az adatokat Prof. Stephen Bustin, Egyesült Királyság).
A szonda jelölésének hitelesítése
A nyers adatok vagy a többkomponensű diagram hasznos diagnosztikai eszköz annak vizsgálatára, hogy a reakcióba a megfelelő koncentrációjú szonda került-e be, és hogy a szonda megfelelően van-e jelölve és kioltva. A 11.9. ábra egy három szondát tartalmazó reakció multikomponens-diagramját mutatja. Az első kettő amplifikációs plotot hoz létre, és a háttér-fluoreszcencia nyilvánvaló. A harmadik szondától nincsenek adatok, és a nyers adatok vizsgálata azt mutatja, hogy a háttérfluoreszcencia megegyezik a vizes vakkontrollal, amely nem tartalmaz semmilyen szondát. Ezért ez az adat a reakcióban lévő fluoreszcencia hiányának eredménye. Ennek oka a beállítás során elkövetett hiba lehet, amelyben a szonda nem volt benne, vagy a szonda nem volt jelölve.

11.9. ábra.Három gént mutattak ki ugyanabban a sablonmintában. Két reakció eredményezett amplifikációt (1. és 2.), a harmadik azonban negatív volt. A többkomponensű nézet vizsgálata azt mutatja, hogy a 3. reakció háttér-fluoreszcenciája megegyezik a vizes kontrolléval, ami a jel hiányát jelzi.
A szonda jelölésének további ellenőrzése DNáz I emésztéssel végezhető. Ezt rendkívül óvatosan kell elvégezni, hogy a szonda- és primerkészletek ne szennyeződjenek enzimmel, ami katasztrofális eredményekhez vezetne. A reakcióban szereplővel egyenértékű, pl. 300 nM-nyi, hibás szondából (11.10A ábra) egy aliquotot inkubálunk DNáz I-vel és anélkül. Ez elvégezhető valós időben (11.10B ábra) úgy, hogy a fluoreszcens hozamot az idő függvényében mérjük, vagy alternatívaként a kezdeti és a végpont (10 perc után) leolvasása elegendő információt nyújt. E vizsgálat elvégzésekor fontos, hogy az adatokat egy jól működő, azonos fluoreszcens jelöléssel és fojtószerrel rendelkező szondával hasonlítsuk össze (11.10B ábra).

11.10. ábra. A)Két templátot detektáltunk különböző szondákkal, mindkettő FAM-jelölt. Míg az egyik szondával történő detektálás magas fluoreszcens jelet eredményezett, a másik sokkal gyengébb volt. B) Egy kontroll és egy teszt szondát (300 nM) 37 °C-on inkubáltunk egy valós idejű műszerben DNáz I pufferben DNáz I enzim jelenlétében vagy hiányában. Az 1. szondából származó fluoreszcens felszabadulás körülbelül kétszerese volt a 2. szondából származónak, ami azt mutatja, hogy a 2. szonda jelölése nem volt megfelelő.
Amplifikációs diagramok
Az amplifikációs diagramok szerkezete és a technikai ismétlések reprodukálhatósága rengeteg információt nyújt a qPCR-vizsgálat minőségéről, és egyben az első figyelmeztető jeleket is adhatja arra, hogy nem minden úgy van, ahogyan lennie kellene. Az 11.11A. ábra -ban látható amplifikációs diagramok nem tipikusak, nagyon zajosak, és nehéz lenne pontosan értelmezni őket. A dR fluoreszcenciaértékek további vizsgálata azt mutatja, hogy a végponti fluoreszcens hozam mindössze 400 egység, ami azt jelzi, hogy a reakció nem megfelelő, de az amplifikációs ábrákat a műszer szoftvere generálta és automatikusan méretezte. Hasonlóképpen, a 11.11B ábra adatai a profil elején kifejezett rókafarkat (csökkenő görbét) mutatnak, majd egy alapvonalszakasz után ismét emelkednek. A rókafarok megjelenése két reakcióban is következetes, de az egyik reakciónak sokkal alacsonyabb a végpontja (11.11.11C ábra), ami egy felerősödött, relatív rókafarkat eredményez.
11.11.11. ábra. A) Az alacsony fluoreszcenciájú, gyenge adatoknak a műszer szoftver általi automatikus skálázása miatt zajos amplifikációs ábrák. B) Az alacsony dR végpontot eredményező reakcióknak kifejezett kezdeti foxtailja van. C) A foxtail a jó minőségű próbához viszonyítva normális hatásnak tekinthető.
Hasonlóképpen, a 11.12A. ábra -ban szereplő amplifikációs plotok egyértelműen abnormálisak, és nem használhatók a bemutatott formában. A nulla dR alá süllyedő amplifikációs diagram (11.12A ábra) klasszikus jele annak, hogy nem megfelelő alapbeállításokat alkalmaztak. A reakció nyers adatainak vizsgálata (11.12B ábra) azt mutatja, hogy a tényleges amplifikációs ábrák normális profillal rendelkeznek, ami megerősíti, hogy az elemzett adatok a műszer szoftverprobléma eredménye. A megfelelő alapvonal a nyers adatokból levezethető és a szoftverben alkalmazható. Ebben az esetben a 6-16. ciklusok a reakció kezdeti lineáris, alapvonal fázisát képviselik, és alkalmazásuk esetén normális amplifikációs plotokat eredményeznek (11.12C ábra).

11.12. ábra. A)Az erősítési ábrák egyértelműen abnormálisak voltak, a profil egy szakasza az alapvonal alá süllyedt. B) A nyersadat-diagram vizsgálata azt mutatja, hogy a reakcióadatok a vártnak megfelelően alakulnak. C) A műszer alapvonalának beállítása a megfelelő ciklusoknak megfelelően visszaállítja a normális profilt az elemzett amplifikációs plotok adatain.
Az amplifikációs grafikon profilja értelmezhető úgy is, hogy információt adjon a vizsgálat minőségéről és az optimalizálásról. A 11.13. ábra egy 10-szeres sorozathígítású templát amplifikációs kísérletét mutatja, minden egyes koncentrációval kétszeres qPCR futtatással. A replikátumok közötti reprodukálhatóság gyenge, a cikluskülönbség (ΔCq) az adatok között nem állandó, és nem 3,323 ciklus, ahogy az 10-szeres sorozatos hígítás esetén elvárható. Az amplifikációs grafikonok vizsgálata, figyelembe véve, hogy ez egy standard görbe, azt mutatja, hogy a vizsgálat a standard alatt van, és nem használható elemzésre. Az okok további vizsgálatot igényelnének, de lehet, hogy a következőkből adódnak; rossz assay-tervezés (lásd PCR/qPCR/dPCR Assay Design), szuboptimális vizsgálati körülmények (lásd Assay-optimalizálás és validálás), vagy rossz pipettázás (ismételt assay).

11.13. ábra.A cDNS-mintát 10-szeres sorozathígítással hígítottuk, és a specifikus templát minden egyes hígításnál kétszeres qPCR segítségével detektáltuk. A replikátumok gyengék, ami a pipettázással vagy a vizsgálat optimalizálásával kapcsolatos problémára utal.

11.14. ábra.Egy standard qPCR során az adatok hirtelen nem tipikus profillal emelkednek felfelé.

11.15. ábra.Csökkenő vagy horgas fluoreszcencia-értékek esetén a lehetséges ok az lehet, hogy a komplementer szál versenyez a primerrel és/vagy a szondával a templáthoz való kapcsolódásért. Figyelmen kívül kell hagyni, amíg a Ct értéket nem befolyásolja.
Dissociációs / olvadási görbék
A disszociációs vagy olvadási görbe elemzést a qPCR után futtatják, és egy olyan elemzési eszköz, amelyet DNS-kötő festékekkel (mint például a SYBR Green I) vagy nem lebomló szondákkal, mint például a Molecular Beacons vagy a Scorpions® Probes együtt használnak annak igazolására, hogy egyetlen termék amplifikálódott. A PCR-amplikációt követően a kapott amplikont növekvő hőmérsékleten inkubáljuk, és a fluoreszcens jel változását a DNS kettősszálú és egyszálú állapotok közötti átmenet során észleljük. Ha a reakció egyetlen amplikont tartalmaz, akkor ez egyenletesen olvad, és a dF/dT (a fluoreszcencia változásának sebessége a hőmérséklet függvényében) grafikonja egyetlen csúcsot mutat. Az olvadási görbe vizsgálata különösen hatékony, ha kontrollok adataival kombináljuk. A 11.16A ábra a qPCR utáni olvadási profilt mutatja a kísérleti vizsgálati minták, a pozitív kontroll és a templát nélküli kontroll sorozatához. A tesztminták olvadási profilja megegyezik a pozitív kontrolléval, és mindegyikük egyetlen csúcsot mutat a dF/dT esetében. A templát nélküli kontroll olvadékprofilja szélesebb profilú és alacsonyabb Tm értékű. Ezek a megfigyelések mindkettő összhangban van azzal, hogy a negatív kontrollban primer dimerek jelenléte nyilvánvaló. Ezt etídium-bromiddal festett agarózgéllel (11.16B. ábra) is megerősítettük, amely szintén azt mutatja, hogy a primer dimerek akkor válnak láthatóvá, ha a templát alacsony koncentrációban van jelen. Ez a célpont túlbecslését okozza, amikor alacsony célpont-koncentrációjú mintákban detektálják. Ezért az assay-t optimalizálni kell vagy újra kell tervezni. Ezzel szemben, A 11.16C ábra azt mutatja, hogy a termék olvadási profilja a templát nélküli kontrollban azonos a pozitív kontroll és a vizsgálati minta olvadási profiljával. Ez egyértelműen jelzi, hogy a templát nélküli kontroll a kísérlet beállítása során templátokkal szennyeződött. Az utolsó példa a cDNS-mintában jelen lévő gDNS-ből származó céltárgy amplifikációjának felismerését mutatja be (11.16D ábra). A gDNS-ből származó amplikon hosszabb, és ezért magasabb a T
Tm értéke, mint a cDNS-ből származóé.

11.16A. ábra.A pozitív kontrollt, a tesztreakciót és az NTC-t amplifikálták, majd poszt-PCR olvadáselemzésnek vetették alá. Az NTC-ben olyan termék látható, amely alacsonyabb hőmérsékleten és szélesebb olvadási csúccsal olvad, ami összhangban van a primer dimer képződésével.

11.16B. ábra.A primer dimerek nyilvánvalóak az ilyen minták gélfelbontásán (másokkal együtt), a primer dimerek képződése fordítottan arányos a bemeneti templát koncentrációjával.

11.16C. ábra.Példa az olvadási görbe elemzésének alkalmazására az NTC reakciószennyezésének azonosítására.
11.16D ábra.Egy nagyobb amplikon azonosítása, amely a gDNS PCR során keletkezett.

11.17. ábra. A)A) olvadási profil és B) egy SYBR green I reakció agarózgél-elemzése. Bár az olvadási profil különböző Tm-értékű termékeket jelez, a gélkép azt mutatja, hogy egyetlen amplikon van jelen. Ez olyan amplikonszekvenciára utal, amely AT- vagy GC-gazdag régiókat vagy ismétlődő elemet tartalmaz, ami szabálytalan olvadást eredményez.
A sablon sorozatos hígítása/szabványgörbék
Függetlenül attól, hogy a kísérleti terv tartalmazza-e a standardgörbe követelményét az esetleges mennyiségi meghatározáshoz, a megfelelő sablon sorozatos hígításának kimutatása hatékony megközelítés az assay validálásához és a hibaelhárításhoz. A sorozatos hígítás detektálása lehetővé teszi az assay kísérleti lineáris dinamikai tartományának meghatározását. A 11.18A ábra egy standardgörbét mutat, amelynek alacsony koncentrációjú adatpontjai nem illeszkednek a lineáris profilba. Ennek az adatmintázatnak a legáltalánosabb oka az, hogy az alacsony koncentrációjú mintákban primer dimerek képződtek (amint azt a 11.18B ábra mutatja). Ez a standardgörbe a 11.2. ábra adataiból készült. A 11.18C ábra egy olyan standardgörbét mutat, ahol a nagy koncentrációjú minták kiesnek a lineáris tartományból. Ennek leggyakoribb oka a reakció sablonos gátlása vagy az, hogy az alapvonal beállításai nem megfelelőek.

11.18. ábra. A) Az alacsonyabb célkoncentrációkra vonatkozó adatpontok nem fekszenek a standard görbére. B) Ez jellemző a primer dimereket eredményező reakcióra, ahogyan az ábrán látható. Ebben az esetben az alacsony koncentrációjú minták esetében nem figyelhető meg a Cq növekedése.

11.18C. ábra.A magas templátkoncentrációjú minták nem helyezkednek el a standard görbén. Ez jellemző a templátkoncentráció által gátolt reakciókra vagy a hibás alapvonal-beállítás miatt.
A standardgörbét a reakció hatékonyságának mérésére is használják a hígítások dinamikus tartományában. Ügyelni kell arra, hogy a hatékonysági számításokhoz használt összes pont a vonalra essen. A reakcióknak a lehető legközelebb kell kerülniük a 100%-os hatékonysághoz, és a látszólag magas (>110%) vagy alacsony (<85%) hatékonyságú reakciókat tovább kell vizsgálni.

11.19A. ábra.A templát nukleinsavat 10-szeres sorozaton keresztül hígítottuk. Az amplifikációs grafikonok abnormálisan sekély gradienst mutatnak, és a ΔCq a várt 3,3 helyett 4 ciklus.

11.19B. ábra.A reakció hatékonyságának kiszámításához a Cq és a mennyiség közötti standardgörbe gradiensét használják.

11.20A. ábra.A templát nukleinsavat 10-szeres sorozaton keresztül hígítottuk. A ΔCq az amplifikációs sorozatok között 1,5 ciklus, nem pedig 3,3 ciklus.

11.20B. ábra.A Cq és a mennyiség közötti standard görbe gradiensét a reakció hatékonyságának kiszámításához használják, amely közel 140%.

11.20C. ábra.Az olvadási görbe profiljának vizsgálata azt mutatja, hogy az alacsonyabb koncentrációjú minták (sárga és kék nyomok) az amplifikált primer dimerekből származó jelet is tartalmaznak (csúcs alacsonyabb Tm-nél).
Troubleshooting RT-PCR esettanulmányok
Egy sikertelen szondás próba
Egy szondán alapuló próbát terveztek EIFB1 kimutatására humán cDNS-mintákban, de nem mutatott amplifikációt. A kezdeti reakciókat egy ABi StepOne műszeren futtattuk kompatibilis reagensekkel. Megkísérelték a primerek optimalizálását 200 nM és 900 nM közötti koncentrációtartományt használva (11.21. ábra), de nem történt javulás. A próbatervet ellenőrizték és megfelelőnek találták a célponthoz, és in silico azt jósolták, hogy ez egy kiváló minőségű próba. Új primereket szintetizáltunk, és az eredeti szintézis aliquotjával együtt futtattuk le, más operátor, más SYBR Green I reagensek (tehát más reagensek) és más műszer (egy Eppendorf Realplex) használatával (11.22. ábra). E megközelítés alkalmazása során szem előtt tartottuk, hogy az elsődleges cél a probléma megoldása, míg a másodlagos cél a hiba magyarázata volt. Ez a reakció egyenértékű amplifikációt eredményezett mindkét primer-tételből. Ebben a szakaszban úgy tűnt, hogy a reakció problémája a szondával van, ezért új szondát szintetizáltunk, és a két tételt a második operátor a Realplex műszeren összehasonlította a LuminoCt® reagensek (az eredetileg kipróbáltaktól eltérő reagensek) használatával (11.23. ábra). Mindkét szonda amplifikációs adatokat adott, az új szonda valamivel jobbnak tűnt, mint az eredeti, bár megjegyzendő, hogy az eredeti szondát a vizsgáló laboratóriumok között postázták, és ezért szobahőmérsékleten, oldatban volt több napig. Ebben a szakaszban egyértelmű volt, hogy mind az eredeti, mind a helyettesítő próba működött, amikor a második operátor LuminoCt® reagensekkel futtatta a Realplex műszeren.
Ezért az eredeti hiba fennmaradó okai a következők voltak:
- Operátor: a kísérletet többször megismételte egy tapasztalt tudós, ezért ezt a magyarázatot valószínűtlennek tartották.
- Készülék: lehetett némi probléma, mivel néhány más vizsgálat is sikertelen volt.
- Reagensek: a legkönnyebben tesztelhető magyarázat. A LuminoCt® reagenseket a meglévő reagensekkel hasonlította össze az ABi StepOne műszeren mindkét oligótétel felhasználásával az első operátor. A reakció az eredeti reagensekkel nem sikerült, de a LuminoCt® -reagensekkel jó amplifikációt adott (11.24. ábra).

11.21. ábra.Az EIFB1 primereket 200 nM és 900 nM közötti koncentrációban teszteltük. Egyik feltétel mellett sem tapasztaltunk amplifikációt (oligók és ABi reagensek az ABi StepOne Plus-on).

11.22. ábra.Az EIFB1 primerek két tételét hasonlítottuk össze SYBR Green I reagensben; az eredeti hibás tételt és egy új tételt. (oligók és reagensek az Eppendorf Realplex műszeren). Mindkét primer készlet támogatta az amplifikációt.

11.23. ábra.Az EIFB1 primerek és szondák két tételét hasonlították össze a LuminoCt® reagensben; az eredeti, hibás tételt és egy új tételt. (oligók és reagensek az Eppendorf Realplex műszeren). Mindkét oligókészlet támogatta az amplifikációt.

11.24. ábra.Az EIFB1 primer és szonda vizsgálatot két különböző reagenssel (Original ABi vagy LuminoCt® reagens) végeztük. Ebből a vizsgálatból csak a LuminoCt® reagensekkel végzett futtatás során nyertünk adatokat.
A reakció hatékonysága helytelen és változó volt
A vizsgálatot egy mesterséges oligo sorozatos hígításán végeztük el, standard primer és szonda teszteléssel. Az assay-t eredetileg egy másik műszeren fejlesztették ki és optimalizálták, de a furcsa hígítási hatást nem várták, amikor átvitték egy másik tesztlaborba és műszerre (11.25A ábra). Minden vizsgálati körülményt újraoptimalizáltunk, hogy az új laboratóriumra jellemző legyen, de az adatok nem változtak. A kezelő megfigyelte, hogy a hatás kifejezettebb volt, amikor a vizsgálatot néhány órán belül megismételték, ugyanazt a hígítási sorozatot használva. A hibaelhárítási folyamat részeként a vizsgálatot egy másik műszerrel egy másik kezelő végezte el, aki ismét a várt standardgörbét hozta létre. Ez arra engedett következtetni, hogy a kezdeti probléma a következő okokra vezethető vissza: kezelői hiba, műszerhiba vagy a kísérleti eljárás valamilyen finom eltérése. Mivel mindkét kezelő nagy tapasztalattal rendelkezik, és a műszer más kísérleteknél jól működött, a finom különbségek lehetőségét vizsgálták meg. Fontos támpontot jelentett az ugyanabból a hígítási sorozatból származó adatok változatosságának megfigyelése a minták 4 °C-on történő tárolása után (11.25A és 11.25B ábra). Ez a hígítási sorozathoz használt csövek vizsgálatához és az alternatívák teszteléséhez vezetett. Miután a hígítási sorozathoz Eppendorf 1,5 ml-es reakciócsövekre váltottunk, a megjósolt standardgörbe elkészült (11.25C ábra), ami bizonyítja, hogy a PCR-hez feltétlenül molekuláris biológiai, alacsony visszatartású műanyag edényeket kell választani, és hogy ezek a vizsgálatok érzékenyek a protokoll finom eltéréseire.

11.25A. ábra.A mesterséges oligotemplát 10-szeresére hígítottuk, és egy specifikus szondán alapuló teszttel detektáltuk. Az amplifikációs ábrák között következetlen különbségek vannak.

11.25B. ábra.Egy mesterséges oligotemplát 10-szeresére hígítottunk (ezek azok a hígítások, amelyeket a 11.25A ábrán detektáltunk), és néhány órán át 4 °C-on hagytuk, mielőtt egy specifikus szondán alapuló teszttel detektáltuk volna. Az amplifikációs ábrák között következetlen különbségek vannak, amelyeket a hígítás és a vizsgálat között eltelt idő súlyosbít.

11.25C. ábra.A mesterséges oligo templátot 10-szeresére hígítottuk molekuláris biológiai minőségű csövekbe, és egy specifikus szondán alapuló teszttel detektáltuk. Az amplifikációs grafikonok között a várakozásoknak megfelelően következetes különbségek mutatkoztak.
Summary - PCR hibaelhárítási ellenőrzőlista
- Ellenőrizze a minta minőségét (a lebomlott anyag hibás eredményeket fog okozni).
- Vizsgálja meg, hogy az RT protokoll kompatibilis-e a tervezettel (Pl, egy Oligo-dT alapozású RT-nek a 3' 1 kb szekvenciában qPCR-tesztnek kell lennie).
- Ellenőrizze a teszttervezést.
- Ellenőrizze az összes kontrollt.
- Ellenőrizze a primereket a SYBR green I festékkel / futtasson gélt.
- Visszaigazolja a helyes szoftverbeállításokat (alapvonal, festékdetektálás, standardok koncentrációi).
- Biztosítsa, hogy a ROX koncentrációja alkalmazható a műszerhez (és nem zavarja a multiplexet).
- Ellenőrizze a háttér fluoreszcencia szintjét.
- Ellenőrizze a szondák jelölését DNáz I próbával vagy ismételje meg a szondaszintézist.
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?