S2628
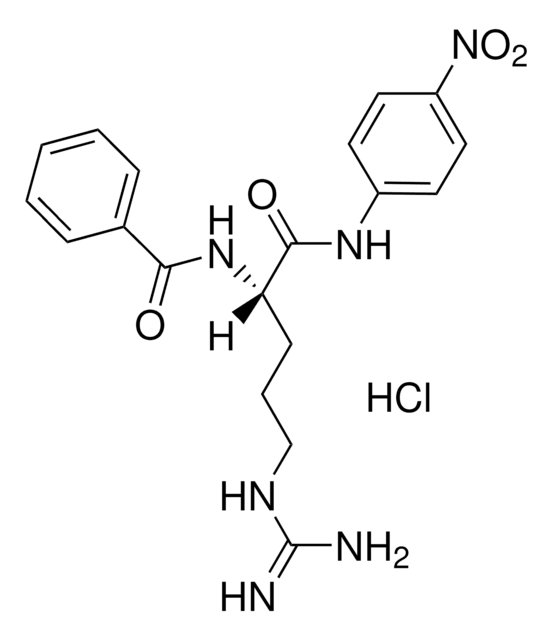
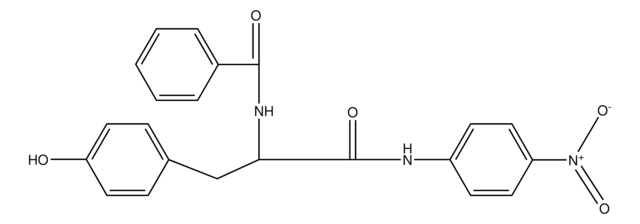
N-Succinyl-L-phenylalanine-p-nitroanilide
protease substrate, ≥98% (TLC), powder
Szinonimák:
Suc-Phe-pNA
About This Item
Javasolt termékek
product name
N-Succinyl-L-phenylalanine-p-nitroanilide, protease substrate
Minőségi szint
Teszt
≥98% (TLC)
form
powder
oldhatóság
dioxane: 25 mg/mL, clear, colorless to faintly yellow
tárolási hőmérséklet
−20°C
SMILES string
OC(=O)CCC(=O)N[C@@H](Cc1ccccc1)C(=O)Nc2ccc(cc2)N(=O)=O
InChI
1S/C19H19N3O6/c23-17(10-11-18(24)25)21-16(12-13-4-2-1-3-5-13)19(26)20-14-6-8-15(9-7-14)22(27)28/h1-9,16H,10-12H2,(H,20,26)(H,21,23)(H,24,25)/t16-/m0/s1
Nemzetközi kémiai azonosító kulcs
KNBLWBFJHZHYFG-INIZCTEOSA-N
Alkalmazás
Biokémiai/fiziológiai hatások
Szubsztrátok
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Egyéni védőeszköz
Eyeshields, Gloves, type N95 (US)
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Az ügyfelek ezeket is megtekintették
Cikkek
Analytical Enzyme Chymotrypsin: Chymotrypsin is produced in the acinar cells of the pancreas as the inactive precursor, chymotrypsinogen.
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással