Fontos dokumentumok
B1508
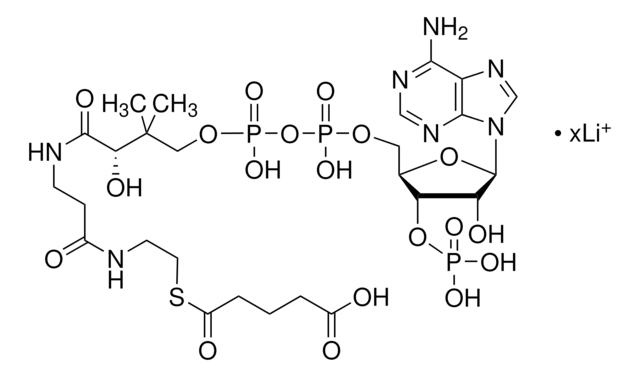
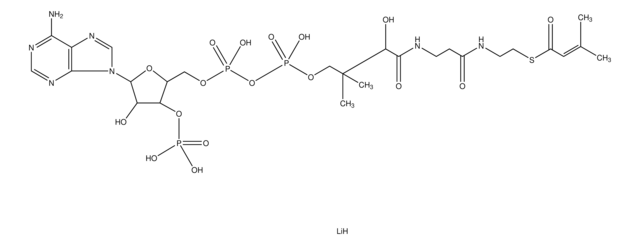
Butyryl coenzyme A lithium salt hydrate
≥90%
Szinonimák:
Butyryl-CoA lithium salt hydrate
About This Item
Javasolt termékek
biológiai forrás
synthetic (Organic)
Minőségi szint
Teszt
≥90%
form
powder
oldhatóság
H2O: soluble-50 mg/mL, clear, colorless
tárolási hőmérséklet
−20°C
SMILES string
[Li+].[Li+].[Li+].[Li+].CCCC(=O)Nc1ncnc2n(cnc12)[C@@H]3O[C@H](COP([O-])(=O)OP([O-])(=O)OCC(C)(C)C(O)C(=O)NCCC(=O)NCCS)[C@@H](OP([O-])([O-])=O)[C@H]3O
InChI
1S/C25H42N7O17P3S.4Li/c1-4-5-16(34)31-21-17-22(29-12-28-21)32(13-30-17)24-18(35)19(48-50(38,39)40)14(47-24)10-45-51(41,42)49-52(43,44)46-11-25(2,3)20(36)23(37)27-7-6-15(33)26-8-9-53;;;;/h12-14,18-20,24,35-36,53H,4-11H2,1-3H3,(H,26,33)(H,27,37)(H,41,42)(H,43,44)(H2,38,39,40)(H,28,29,31,34);;;;/q;4*+1/p-4/t14-,18-,19-,20?,24-;;;;/m1..../s1
Nemzetközi kémiai azonosító kulcs
FKMUWGIOOMBTED-VLFKLNKMSA-J
Alkalmazás
Biokémiai/fiziológiai hatások
Figyelmeztetés
Warning
Figyelmeztető mondatok
Óvintézkedésre vonatkozó mondatok
Veszélyességi osztályok
Eye Irrit. 2 - Skin Irrit. 2 - STOT SE 3
Célzott szervek
Respiratory system
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Egyéni védőeszköz
dust mask type N95 (US), Eyeshields, Gloves
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Az ügyfelek ezeket is megtekintették
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással