Tippek az immunfluoreszcencia protokollokhoz
Bővebben
- Immunfestés fluoreszcens antitestekkel
- Fluoreszcens immunfestés az ICC számára: Lépésről lépésre
- Antitest és fluorofór kiválasztása
- Kiegészítő megfontolások a fluorofór kiválasztásakor
- Fluorescence Protection Program: A fluoreszcens antitestek és reagensek élettartamának meghosszabbítása
- Az antitestek kiválasztása: Festési technika
- Antitest kiválasztása:
- Kísérleti kontrollok az IF-ICC-hez
- Kísérleti kontrollok IF-ICC-hez
- Bennfentes tanácsok a legjobb jelek eléréséhez - és a háttér legyőzéséhez - az IF-ICC-vel
- Kapcsolódó termékek
Immunfestés fluoreszcens antitestekkel
Az immunfluoreszcencia (IF) felhasználási területei.amikor egy antitestet egy olyan molekulához kötnek, amely lézerrel gerjesztve fluoreszkál - többek között a fehérje lokalizációja, a poszttranszlációs módosítás vagy aktiválás megerősítése, valamint más fehérjékhez való közelség vagy más fehérjékkel való komplexképzés. Az immuncitokémia (ICC) egy jól ismert technika, amely antitesteket használ a sejtmintákban lévő célpontokhoz való kötődéshez, és Coons et al írta le először az immunodetektálást fluoreszcens riportmolekula segítségével 1942-ben. Amellett, hogy információt szolgáltat a szubcelluláris célpontokról, az immunfluoreszcencia és az immuncitokémia kombinálása az élettudományok legmeggyőzőbb vizuális adatai közé tartozik. Ebben az útmutatóban az antitestekkel foglalkozó tudósok megosztják, mit tudunk arról, hogy a lehető legjobb képet kapjuk az IF-ICC kísérletekből.
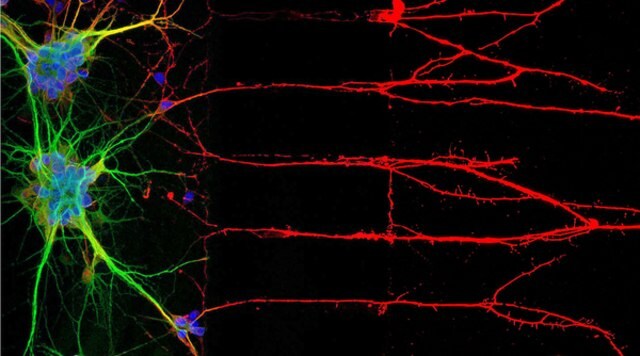

1. ábra: Az immuncitokémia (ICC) a neuronmagokhoz, a szómához és az axonokhoz kapcsolódó fehérjéket lokalizál (balra). Jobbra az U-251 MG humán sejtvonal immunfluoreszcens festése.

2. ábra.Fluoreszcens immunodetektálás
Az immunfluoreszcencia protokoll egyes lépéseinek optimalizálása szükséges lehet a legjobb eredmények elérése érdekében, olyan tényezők alapján, mint a célpont szubcelluláris elhelyezkedése és az antigén jellemzői.
Minta előkészítése:
A sejtnövekedési formátumtól függetlenül a sikeres IF-ICC képalkotás az egészséges minták megfelelő tenyésztési sűrűséggel történő betakarításával kezdődik.
Szuszpenziós sejt:
A sejttípusok moshatók a médium eltávolítása és reszuszpendálása céljából, majd festhetők kis térfogatú csövekben, mielőtt a mikroszkópos vizsgálathoz tárgylemezre rögzítik őket. A szuszpenziókat először mikroszkóposan meg kell vizsgálni a morfológia szempontjából, és nem haladhatják meg a sejtvonalhoz ajánlott konfluencia/titer értéket ahhoz, hogy alkalmasnak minősüljenek az immuncitokémiára. Az egészséges, szubkonfluens tenyészetek nem lesznek túlzottan zavarosak, és nem mutatnak a közeg savasodására utaló sárgulást. A sejteknek mikroszkópos vizsgálat során világosnak és kerekdednek kell tűnniük. A százalékos életképesség hemocitométerrel és trypan-kék kizárással határozható meg. A mosást követően a sejteket 1 -2 x 106 sejtek/ml mennyiségben kell reszuszpendálni, akár oldatban történő ICC-festéshez, akár a sejtek fokozott tapadásához speciálisan kezelt tárgylemezeken történő későbbi festés céljából történő kenetfelvitelhez.
Amikor adherens sejteket tenyésztünk (és esetleg kezelünk), hogy a célpont-expresszióra gyakorolt hatást IF-ICC-vel vizsgáljuk, a sejtek elültethetők kamrás tárgylemezekre, amelyek optikai képalkotásra optimalizált, egy- vagy többkamrás felépítményekkel ellátott tárgylemezek, amelyek lehetővé teszik a tenyésztéshez szükséges médium hozzáadását. A kamrás tárgylemezek lehetővé teszik a közvetlen átmenetet a sejtkultúráról a szondázásra és a képalkotásra. Az adherens sejttípusok mikroszkópos tárgylemezekre is vethetők, amelyek médiummal töltött mélyedésekbe vannak merítve, amelyeket ezt követően megfestenek és a képalkotáshoz tárgylemezekre rögzítenek.
Függetlenül a tenyésztési felülettől és az edény megközelítéstől, a fedőlemezeken vagy a tárgylemezkamrákban történő sejtnövekedést gondosan figyelemmel kell kísérni, hogy a sejteket még a túlnövekedés előtt ki lehessen venni a tenyészetből és immuncitokémia céljából rögzíteni lehessen. A sejteket gyakran akkor képezzük le, amikor a konfluencia (a sejtek által lefedett felület mennyisége) 50-80%-os tartományban van. Ha a sejtek életképességét az immunfestés előtt véglegesen meg kell határozni, egyes kutatók olyan festékeket használnak, mint a ethidium homodimer., egy olyan nukleáris markert, amely nem képes áthatolni az élő sejtek ép sejtmembránján - így az életképes és nem életképes sejtek sejtmagjában egyaránt fluoreszkáló DAPI-val történő festés segíthet a százalékos életképesség számszerűsítésében az etídiummal festett sejtmagok számaként / a kettős festésű sejtmagok számaként. Alternatívaként, kereskedelmi forgalomban kaphatók élő/holt sejt készletek amelyek gyakran kalceint és propídium-jodidot használnak az élő és az elhalt sejtek megkülönböztetésére.
Fixálás:
A fixálás és a permeabilizálás egyetlen lépésben is elvégezhető szerves fixálószerekkel, például alkohollal és acetonnal. Szerves oldószereket azonban, nem szabad használni, ha a lipidek integritását fenn kell tartani, mint például amikor a célantigén a membránhoz kapcsolódik. Bár a formaldehid (gyakran polimer formában árulják és használják paraformaldehid) gyakori választás, amely megállítja a bomlást és rögzíti a fehérjéket, a keresztkötő aldehidek akadályozhatják az antitestek hozzáférését egyes antigénekhez, ezért a legkisebb olyan koncentrációban kell használni, amely 10-20 perces inkubáció után hatékonyan megőrzi a szerkezetet, jellemzően 1-4% között a (para)formaldehid esetében. MEGJEGYZÉS: Mivel autofluoreszcencia forrása, a glutaraldehidet a legjobb elkerülni az IF fixálási protokollokban.
Antigén kinyerése:
Egyes célepitópokat elfedhet a zsúfolt sejtes mikrokörnyezetben való komplexképződés vagy a fixálási technikák. Az antigén visszanyerési technikák bizonyítottan javítják az antitestek hozzáférését bizonyos antigén célpontokhoz, de rendkívül óvatosan kell alkalmazni, és előzetesen tesztelni kell, amikor tárgylemezeken lévő sejtekkel dolgoznak, mivel a hő vagy kémiai körülmények, amelyeknek a sejteket kiteszik, általában túl durvák az ICC mintákhoz.
Permeabilizáció:
A rögzített sejtek hatékony permeabilizálására általában Triton-X vagy Tween-20 detergenseket használnak, de ezek a detergensek válogatás nélkül oldják fel a lipideket, és pusztítóbbak lehetnek, mint a szaponin, egy növényi alapú glikozid, amely a koleszterinek szelektív feloldásával perforálja a membránt, lényegében érintetlenül hagyva a szervezeti membránokat. Ha az érdeklődésre számot tartó célpont a sejt belsejében lévő, membránhoz kötött struktúrákban található, akkor az olyan robusztusabb detergensek, mint a Triton-X, a Tween-20, a Brij detergensek vagy az NP-40 nagyobb valószínűséggel biztosítják az antitestek hozzáférését. A szaponin egy gyengédebb permeabilizálószer, amely megőrzi a felszíni antigének integritását, de nem biztos, hogy alkalmas az intracelluláris membránok permeabilizálására, hogy az antitestek hozzáférjenek a sejtmagban vagy más organellumokban lévő célpontokhoz. Mivel a szaponin hatása reverzibilis lehet, és ezért mosáskor elveszhet, a festési protokoll során végig fenn kell tartani a használatát az antitestekhez való hozzáférés biztosítása érdekében.
Blokkolás:
A másodlagos antitest nemspecifikus kötődését hatékonyan blokkolja egy legfeljebb 5%-os normál szérumoldat abból a fajból, amelyben a másodlagos antitestet felnevelték. Ha szérum nem áll rendelkezésre, egy bármilyen szekunderhez alkalmazkodó megközelítés egy általánosabb fehérjeblokkoló, például szarvasmarha szérumalbumin (BSA) használata hasonló hígításban PBS-ben. Egyes laboratóriumok szérum és BSA kombinációját használják az antitest gazdaspecifikus és általános blokkolás eléréséhez. A BSA-t gyakran liofilizálva és folyadékká visszaállítva szállítják, ezért szűrni kell és/vagy rendszeresen meg kell vizsgálni a mintákon lerakódó, festési artefaktumot okozó részecskék tekintetében. A blokkolás az immunfluoreszcencia protokoll során az antitestek blokkoló pufferben történő hígításával tartható fenn.
Antitest és fluorofór kiválasztása
Fluorofór kiválasztása
A sejteket ICC-vel vizsgáló fluoreszcenciakísérletek tervezésekor az első szempont mindig az elemzéshez használt mikroszkóp optikai konfigurációja kell, hogy legyen. Az IF-ICC protokollok egyetlen célpont jelölésére használhatók, de számos fluoreszcens mikroszkóp konfiguráció alkalmas a multiplexing, vagy több célpont egyidejű festésére, a sejtmaggal együtt. Az alábbiakban egy mintakísérleti paletta látható három célpont és a sejtmag festésére:
A fluoreszcens mikroszkópok egyedi konfigurációkkal rendelkeznek a gerjesztéshez és az emisszióhoz. A mikroszkópokat gyárilag nagy intenzitású fényforrásokkal, például ívlámpákkal vagy lézerekkel szerelik fel, amelyek meghatározott hullámhosszon bocsátanak ki fényt, amely képes a kompatibilis fluorofórok gerjesztésére. A szűrőkészletek a gerjesztett fluoroforok által kibocsátott fény hullámhossz-tartományát rögzítik, amely lehet széles a maximálisan rögzített emisszió érdekében, vagy keskeny a specifitás optimalizálása és az emissziós csatornák átfedésének csökkentése érdekében. A fenti táblázatot példaként adtuk meg a szokásos fluoreszcens mikroszkóp-konfigurációk alapján. Kérjük, konzultáljon a műszer lézer- és szűrőkonfigurációival, hogy segítsen kiválasztani a legjobb fluorofór-konjugált antitesteket az immunfluoreszcencia ICC- vagy IHC-protokolljához. A mikroszkópiai magtudósok gyakran hasznos forrásként szolgálnak az IF-kísérletek tervezéséhez.
Kiegészítő megfontolások a fluorofór kiválasztásakor
Photostabilitás: A fluorofórmolekulák környezeti fénynek vagy mikroszkópia közbeni gerjesztésnek való túlzott kitettsége vagy gerjesztése következtében a fluorofórmolekulák fotoblokkolása, vagyis a fluorofórok visszafordíthatatlan, fény által okozott károsodása, amely befolyásolja a fluoreszcencia képességüket. Sok mindenütt elterjedt fluorofór, mint például a FITC és a TRITC, széles körben elérhető, mivel nem védett, és a piacon való hosszú élettartamuk miatt - de sokkal érzékenyebbek lehetnek a fotoblokkolásra, mint a későbbi generációs fluorofórok, amelyek más kémiai összetevőket használnak.
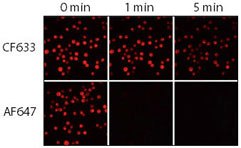
3. ábra.A CF633 és az Alexa Fluor 647 (AF647) kecske anti-egér konjugátumok relatív fotostabilitása. A Jurkat sejteket fixáltuk, permeabilizáltuk és nyúl anti-CD3-mal, majd CF633 vagy Alexa Fluor® 647 kecske antinyúl IgG konjugátummal festettük. A mintákat Cy5 szűrőkészlettel és CCD-kamerával felszerelt higanylámpás mikroszkóp segítségével képeztük le. A sorozatfelvételeket 0, 1 és 5 percenként készítettük.
Fluoreszcens szondát tartalmazó hígított antitest munkaoldatok előállításakor fontolja meg, hogy ezt a munkaoldatot fényvédett edényben, például borostyánszínű üvegben hígítsa. A munkaoldatok gyakran hosszabb ideig vannak kitéve fénynek, mint a tárolt törzsoldatok vagy a kereskedelmi antitest-előkészítmények, így ez a fényexpozíciót csökkentő extra intézkedés további védelmet nyújthat a felhasználási forgatókönyvek során.
Fluorescence Protection Program: Meghosszabbítja a fluoreszcens antitestek és reagensek élettartamát
A fluoreszcens reagensek speciális tárolást és kezelést igényelhetnek a fluoreszcens egység fotostabilitásának, valamint magának az antitestnek a funkcionális integritásának megőrzése érdekében. Győződjön meg arról, hogy a reagens a szállító szállítási dokumentumaiban megadott hőmérsékleti körülmények között érkezik, és szállítsa át a gyártó által ajánlott laboratóriumi tárolóhelyre, hogy a fény- és hőmérsékleti viszonyok ne sérüljenek. Az antitestkészlet érkezésekor kisebb térfogatokba történő aliquotálása (replikált címkézéssel) védi a reagens integritását azáltal, hogy korlátozza a törzsoldat fagyasztás-felolvasztás, jégtartály-változás vagy egyéb hőmérséklet-változások, illetve a környezeti fény hatásának való kitettségét.
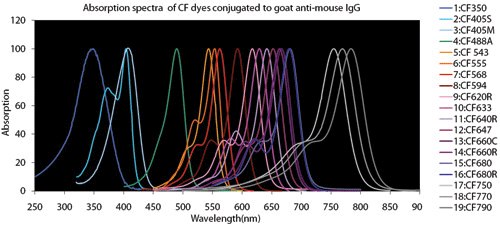
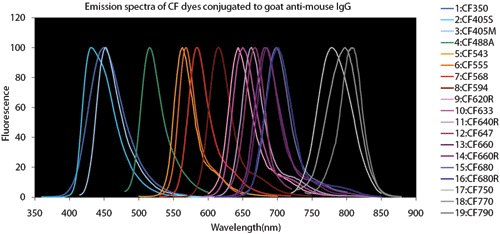
4. ábra.Fluoreszcens festék összehasonlító táblázatok
Spektrális átfedés: Amikor multiplex kísérleteket végez, hogy több célpontot detektáljon ugyanabban a mintában, vegye figyelembe a fluorofór spektrális jellemzőit, a lézer hullámhosszát és a mikroszkóp szűrőtartományait. A mikroszkóp emissziós szűrőkonfigurációkat úgy kell megválasztani, hogy a spektrális átfedés csökkenjen, de jó gyakorlat az olyan fluorofórok kiválasztása, amelyeknek nincs hosszú emissziós "csóvájuk", amely átcsaphat egy szomszédos szűrőcsatornába.

5. ábra.A CF543 és az Alexa Fluor 546 (AF546) kecske anti-egér konjugátumok relatív fluoreszcenciája a festékmolekulák fehérjenkénti számának függvényében (jelölési fok).
Antibody Selection:
Antibody Selection
Direkt festés: Egyes kutatók értékelhetik a "közvetlen festés" módszerének kényelmét, amelyben az elsődleges antitestet közvetlenül egy fluorofórhoz konjugálják, mivel a kötődés és a fluoreszcens detektálás egyetlen lépésben valósul meg, és az IF-ICC protokoll teljesítéséhez szükséges teljes idő csökken.A közvetlen konjugátumok megkönnyítik több célpont multiplex festését is ugyanabban a mintában, mivel a keresztreaktivitás elkerülése érdekében nem kell különböző gazdatestekből származó primer antitesteket választani (a multiplex IF-ICC-ről bővebben alább).
Ha primer antitest-konjugátumot használunk, ezt a lépést sötétben kell elvégezni, hogy a fluorofort megvédjük a fotobleachingtól. Az elsődleges konjugáttal történő inkubációt követően a protokoll azonnal folytatható a mosással és a montírozással. Az antitestek koktélja használható a minta több célpontjának egyetlen lépésben történő festéséhez.
Közvetett festési módszer: Az "indirekt" immundetektálás során a célpontra specifikus, nem jelölt primer antitestet egy fluorofórral konjugált másodlagos antitest követi, amely az elsődleges antitest gazdafaját detektálja. Ez a technika a jelerősítés egyértelmű előnyével jár, mivel lehetőség van arra, hogy több fluorofórral rendelkező másodlagos antitest kötődjön az elsődleges antitesthez, növelve a fluoreszcenciát kibocsátó molekulák számát az antigén helyén.
Az egyidejűleg több antigén egyazon mintában történő többszörös célzás további megfontolásokat igényel az indirekt detektálási módszerrel kapcsolatban, amint azt az alábbiakban kifejtjük.
Az antitest kiválasztása: célzott, specifikus reaktivitás
Primer antitest:
Az indirekt detektálás során az antitesteket a multiplex kísérletekhez koktélban alkalmazzuk, mind az elsődleges, mind a másodlagos inkubációs lépéseknél. Ezért lényeges, hogy minden egyes célponthoz olyan primer antitesteket válasszunk, amelyeket különböző gazdában neveltünk. Ez biztosítja, hogy a másodlagos koktélban lévő minden egyes konjugált antitest egy egyedi primer antitesthez kötődjön a mintában. Ha nem választunk egyedi gazdatesteket minden egyes célantitesthez, az értelmezhetetlen festési eredményeket fog eredményezni. Az alábbiakban egy mintakísérleti elrendezést mutatunk be a multiplex indirekt kimutatáshoz:
Ebben a példában, ha a kutató ehelyett nyúl anti-B primer antitestet választana, mind az anti-A, mind az anti-B ellen a nyúl ellenes másodlagos konjugátum célpontja lenne, és mind az A, mind a B célpontot zöld fluoreszcens jel jelölné.
Primer antitest-szövet keresztreaktivitás: Az indirekt festéshez használt antitestek kiválasztásakor tanácsos leválasztani minden olyan primer antitestet, amelyet ugyanabban a gazdaszervezetben neveltek, ahonnan a minta származik - például ne használjon egér primer antitestet egérszöveten. Az egérellenes szekunderrel való követés valószínűleg a szekunder antitest széles körű kötődését eredményezné közvetlenül a szövethez, ami jelentős háttérfestést okozna. Bár forgalmaznak olyan készleteket, amelyek célja a gazdatest-ön-self reaktivitás blokkolása, a legkockázatmentesebb eljárás a gazdatest-ön-self elkerülése az indirekt protokollokhoz használt primer antitestek kiválasztásakor. MEGJEGYZÉS: a gazdatest-ön-self keresztreaktivitás általában nem jelent problémát a közvetlen festési módszereknél.
Szekunder antitest:
Amint azt fentebb kifejtettük (Az antitest kiválasztása: festési technika, az indirekt módszer, fentebb), az "indirekt" IF-ICC lehetővé teszi a jelerősítést, mivel több másodlagos antitest is megkötheti a célponthoz kötött primer antitesteket. Az indirekt IF-ICC azonban azt is lehetővé teszi a laboratórium számára, hogy egy moduláris könyvtárat építsen fel másodlagos antitestekből amelyek kompatibilisek lesznek a primer antitestek egyre növekvő gyűjteményével, így bármely célpont bármely rendelkezésre álló mikroszkóp szűrőcsatornához hozzárendelhető.
Mosás:
Az antitest vagy más fluoreszcens szonda minden egyes alkalmazása után végzett mosás eltávolítja a mintában jelen lévő, alacsonyabb kötési affinitású antitesteket, és így csökkenti a nem specifikus jelet, illetve a keresztreaktivitást. A mosási lépés fontosságát nem lehet eléggé hangsúlyozni. Néhány perces mosás PBS -ben legalább két puffercserével segít eltávolítani a mintából a nem kötött és a lazán kötött antitesteket.
A hosszabb mosások nem biztos, hogy észrevehető háttércsökkentő előnyt biztosítanak, de általában nem károsak, amíg a pufferben töltött hosszabb idő nem oldja le a mintát a tárgylemezről vagy a fedőlemezről. A nagyon rövid mosások kevesebb ismétléssel nem tudják hatékonyan eltávolítani a nem specifikusan a célponthoz kötött antitestet, ami rossz jel:háttér arányhoz vezethet.
Nukleáris ellenfestés és rögzítés:
Az IF-ICC-t végző kutatók közül sokan kívánnak olyan fluoreszcens reagenseket használni, amelyek a sejtmagot jelölik, mint például a DAPI vagy a Hoechst. Mivel mindkettő interkalálódik, és a DNS-hez való hozzáférés után másodperceken belül fluoreszkálóvá válik, a DAPI-t tartalmazó montírozóközeg használható a sejtmagfestés és a montírozás egyetlen lépésben történő megvalósításához. Ez időt takarít meg azáltal, hogy nincs szükség külön DAPI/Hoechst festési és mosási lépésekre, és csökkenti a koncentráció és az inkubációs idő ingadozását a nukleáris ellenfestésnél.
Minden montírozó közeg segít a fedőlap rögzítésében a tárgylemezhez, és a dehidratáció megakadályozásával megőrzi a mintát a mikroszkópiához. Sok montírozó médiumot úgy is összeállítottak, hogy optimalizálják a törésmutatót a mikroszkópiához, és tartalmazhatnak olyan anyagokat, amelyek megvédik a festett mintához kötött fluorofórokat a fotobleachingtól.
Kísérleti kontrollok az IF-ICC-hez/span>
Mint más kísérleteknél, a pozitív és negatív kontrollok bevonása növeli a fluoreszcens ICC eredmények érzékenységébe és specificitásába vetett bizalmat.
Az IF-ICC-kísérletek kontrolljai lehetnek:
A primer kihagyása:
Egy egyszerű, bármely ICC-kísérletbe könnyen beilleszthető kontroll, amikor az indirekt immunodetektálási protokollban az elsődleges festési lépésből kihagyjuk az elsődleges antitestet. Ez megmutatja, hogy a megfigyelt jel a fluoreszcens másodlagos antitest nem specifikus kötődéséből adódhat-e közvetlenül a mintához.
Izotípus kontroll:
A konjugált primer antitestekkel történő közvetlen festés esetén egy olyan minta, ahol az elsődleges konjugátumot egy azonos fluorofórral konjugált izotípus kontrollal helyettesítjük, segít biztosítani, hogy a megfigyelt jel az elsődleges antitest antigénre való specifitásából adódjon. Az izotípus-kontrollok gyakran az antitest-konjugátum szállítójától kaphatók, és ugyanabba az osztályba és immunglobulin-típusba tartoznak, mint az antigén ellenes antitest, de nem rendelkeznek specifitással semmilyen ismert epitópra. Az izotípusok az elsődleges antitest kontrolljaként szolgálnak, mivel bevonásuk azt bizonyítja, hogy a megfigyelt jel nem magának az elsődleges antitest fehérjének puszta "ragadós" voltából ered.
A célantigénre negatív sejtek:
Egy sejttípusról ismert, hogy nem expresszálja a kívánt antigént, és negatív kontrollmintaként szolgálhat. Alternatív megoldásként a sejtek, amelyekben az érdeklődésre számot tartó célantigént genetikailag úgy módosították, hogy az érdeklődésre számot tartó fehérje ne expresszálódjon (knock-out sejtek), megbízható kontrollt jelentenek a célspecificitás szempontjából, ha rendelkezésre állnak. Az olyan génmódosítási technikák, mint például CRISPR/Cas nukleáz felhasználhatók a célfehérje expressziójának kiütésére, hogy negatív kontroll sejtvonalat hozzanak létre.
A célantigénre pozitív sejtek:
Ha rendelkezésre állnak olyan sejtek, amelyekről korábban kimutatták, hogy a kívánt antigént expresszálják, akár endogén módon, akár a gén "bekopogtatásával" vagy túlterjesztésével, akkor ezek pozitív kontrollként szolgálhatnak annak megerősítésére, hogy a festési protokoll jelet ad, ha a mintában jelen van a célpont.
Insider-tanácsok a legjobb jel eléréséhez - és a háttér legyőzéséhez - IF-ICC-vel
- Amikor csak lehetséges, olyan antitesteket válasszon, amelyekről rendelkezésre állnak olyan adatok, amelyek az ICC-alkalmazásokban elért eredményeket bizonyítják
- A fluoreszcens antitestek spektrális jellemzőit igazítsa a mikroszkóp lézereihez és szűrőihez
- Fixáljon egészséges, szennyeződésektől és csapadéktól mentes, szubkonfluens sejtmintákat
- Az optimális fixálási és permeabilizálási módszer a céltárgytól és annak szubcelluláris helyétől függ
- Az antitesteket blokkoló pufferben hígítsa fel a blokkolás fenntartása érdekében a festési protokoll teljes időtartama alatt
- A fluoreszcens másodlagos antitesttel történő közvetett kimutatás lehetővé teszi a jelerősítést /li>
- A hasonló spektrális jellemzőkkel rendelkező antitest-konjugátumok közül választva válassza a stabilabb fluorofórt, hogy elkerülje a fotobleachingot a hosszú vagy ismételt mikroszkópos expozíciók során - és elkerülje a spektrális átfedéseket
- Mindig tartalmazzon megfelelő festési kontrollokat. Használjon pozitív és negatív biológiai kontrollokat, ha rendelkezésre állnak.
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?