Hogyan készítsünk és használjunk Percoll gradienseket?
A Percoll törzsoldat készítése és hígítása
A Percoll gradiens elkészítéséhez a Percoll (hígítatlan) ozmolalitását először sóoldattal vagy sejttenyésztő közeggel kell beállítani, hogy a Percoll izotóniás legyen a fiziológiás sóoldatokkal. A Percoll 9 rész (v/v) hozzáadása 1 rész (v/v) 1,5 M NaCl-hoz vagy 10X koncentrált sejttenyésztő tápfolyadékhoz egyszerű módja az izotóniás Percoll törzsoldat (SIP) előállításának. A kívánt ozmolalitás végső beállítása sók vagy desztillált víz hozzáadásával végezhető el. Mivel a sejtsűrűség az ozmolalitás függvénye (6. ábra), a törzsoldat ozmolalitását rendszeresen ellenőrizni kell ozmométerrel, hogy a kísérletek közötti reprodukálhatóságot biztosítsuk. A sók jelenlétében aggregálódó szubcelluláris részecskékhez izotóniás Percoll törzsoldat (SIP) készíthető 9 rész (v/v) Percoll és 1 rész (v/v) 2,5 M szacharóz hozzáadásával.
A SIP oldat sűrűsége a következő képlet alapján számítható ki:

Hol:
Vx = a hígító közeg térfogata (mL)
Vo = a hígítatlan Percoll térfogata (mL)
ρo = a Percoll sűrűsége (1.130 + 0,005 g/mL*)
ρ10 = 1.5 M NaCl = 1,058 g/mL (kisebb eltérések más sók esetén)
2,5 M szacharóz sűrűsége = 1,316 g/mL (kisebb eltérések más adalékanyagok esetén)
ρi = az előállított SIP-oldat sűrűsége (g/mL)
Így a SIP sóoldatban ri = 1.123 g/mL, szacharózban lévő SIP esetében ri = 1,149 g/mL, feltételezve, hogy ro = 1,130 g/mL.
*Az analitikai bizonyítványon feltüntetett pontos sűrűség.
A Percoll törzsoldatok hígítása alacsonyabb sűrűségre
Az izotóniás Percoll (SIP) törzsoldatok hígítása alacsonyabb sűrűségre egyszerűen 0,130 g/mL hozzáadásával történik.15 M NaCl (vagy normál erősségű sejttenyésztő közeg) hozzáadásával sejtek esetében, vagy 0,25 M szacharózzal, ha szubcelluláris részecskékkel vagy vírusokkal dolgozunk.
A következő képlet segítségével kiszámítható, hogy mekkora térfogat szükséges a kívánt sűrűségű oldat előállításához.

Hol:
Vy = a hígítóközeg térfogata mL-ben
Vi = a SIP térfogata mL-ben
ρi = a SIP sűrűsége g/mL-ben
.br> ρy = a hígítóközeg sűrűsége g/mL-ben
(sűrűsége 0.15 M NaCl sűrűsége ~1,0046 g/mL) *
(0,25 M szacharóz sűrűsége ~1.032 g/mL)*
ρ = az előállított hígított oldat sűrűsége g/mL-ben
Példa: 55 ml SIP 1,07 g/mL végső sűrűségűre hígításához határozzuk meg a szükséges 0,15 M NaCl mennyiségét.

A fenti képlet hasznos olyan sűrűségek eléréséhez, amelyek nagyon közel állnak a kívánt tényleges sűrűséghez. A hígítóközegek térfogatának és sűrűségének kis eltérései azonban befolyásolják a végső sűrűséget. A tényleges sűrűség meghatározásához javasoljuk a Percoll-oldatok végső sűrűségének denzitométerrel vagy refraktométerrel történő mérését.
Megjegyzés: Az 5. ábrán látható grafikon empirikus útmutatásként is használható a SIP 0,15 M sóoldattal vagy 0,25 M szacharózzal történő hígításával előállított oldatok sűrűségére. Ez a grafikon a SIP hígítására vonatkozik, ahol a SIP 90%-os (v/v) hígítatlan Percoll, amelyet 10%-os (v/v) sóoldat vagy szacharóz hozzáadásával ozmotikusan beállítottak. A félreértések elkerülése érdekében ezért jobb, ha a munkaoldat tényleges sűrűségére hivatkozunk (vagy a SIP %-ban történő megadására), mintha az oldatra az izo-ozmotikus sóoldatban vagy szacharózban lévő Percoll százalékos arányaként hivatkoznánk. Ez különösen fontos az alább ismertetett egylépéses hígítási eljárás alkalmazásakor, amikor az ismert sűrűségű munkaoldatot úgy kapjuk, hogy a Percollt (hígítatlanul) és a koncentrált sót vagy szacharózt desztillált vízzel hígítjuk a végső térfogatig.

5. ábra.Az izotóniás perkoll állomány (SIP) hígítása izozmotikus sóoldattal vagy szacharózoldattal. Po a Percoll sűrűsége (hígítatlanul). A SIP-t a leírtak szerint kell elkészíteni. A feltüntetett kalibrációs vonalak csak tájékoztató jellegűek. A pontos sűrűségmérésekhez a szövegben megadott képletet kell használni.
A Percoll hígításának egylépéses eljárása
A Percoll (hígítatlanul) közvetlenül hígítható, hogy ismert sűrűségű végleges munkaoldatot kapjunk a következő eljárással. Egy mérőhengerben adjunk 1,5 M NaCl-t vagy 2,5 M szacharózt a kívánt végső térfogat 1/10-éig (pl. 10 ml 100 ml munkaoldathoz). Ehhez adjuk hozzá a szükséges (hígítatlan) Percoll-térfogatot, amelyet az alábbi képlet alapján számítunk ki. Töltsük fel a végleges térfogatig desztillált vízzel.

Hol:
Vo = a Percoll (hígítatlan) térfogata (mL)
V = a végső munkaoldat térfogata (mL)
ρ = a végső oldat kívánt sűrűsége (g/mL)
.br> ρo = a Percoll (hígítatlan) sűrűsége (g/mL)
(a pontos sűrűségről az analitikai bizonyítvány ad tájékoztatást)
ρ10 = 1. sűrűség.5 M NaCl = 1,058 (g/mL)
(kisebb eltérések más sók esetében)
2,5 M szacharóz sűrűsége = 1.316 (g/mL)
(kisebb eltérések más adalékok esetén)
Példa: Készítsünk 100 ml 1,07 g/mL sűrűségű Percoll munkaoldatot 0,15 M NaCl-ban. 10 mL 1,5 M NaCl-hez adjunk hozzá

A fenti képlet hasznos olyan sűrűségek eléréséhez, amelyek közel állnak a kívánt tényleges sűrűséghez. A hígítóközegek térfogatának és sűrűségének kis eltérései azonban befolyásolják a végső sűrűséget. A nagyon pontos sűrűség meghatározásához javasoljuk a Percoll-oldatok végső sűrűségének denzitométerrel vagy refraktométerrel történő mérését.
Az 5. ábrán láthatóhoz hasonló grafikonok segítségével a Percoll (hígítatlan) térfogata és a végső sűrűség összefüggésbe hozható.
A Percoll hígítása a kívánt ozmolalitásig
A legtöbb emlőssejt esetében az izotóniás Percoll előállításához 9 rész Percoll (hígítatlan) 1 rész 1,5 M NaCl vagy 2,5 M szacharóz oldattal történő hígítása szokásos. Ezt a Stock Isotonic Percoll (SIP) oldatot ezután a szükségleteknek megfelelően fiziológiai pufferekkel tovább hígítjuk. Bár ez az eljárás sikeresnek bizonyult, meglehetősen leegyszerűsítő, és nem veszi figyelembe a szilárd szilícium-dioxid részecskék jelenlétének hatását (azaz, hogy 100 ml Percoll törzsoldat tartalmaz bizonyos mennyiségű szilárd szilícium-dioxidot, így a teljes vizes térfogat kevesebb, mint 100 ml). A szilícium-dioxid által elfoglalt térfogat miatt a törzsoldatban lévő elektrolitok effektív koncentrációja magasabb, mint a fiziológiás sóoldatban, és az így készült SIP hiperoszmolos lesz. Ezért mindig is ajánlott volt a SIP tényleges ozmolalitásának meghatározása.
Vincent és Nadeau (555) elegánsan tárgyalja a problémát, és leírt egy egyenletet, amellyel kiszámítható, hogy hány rész Percollt kell hozzáadni egy rész 10× koncentrált fiziológiás sópufferhez, hogy bármilyen kívánt ozmolalitású SIP-et kapjunk. A szerzők meghatározták a Percoll törzsoldat teljes térfogatának szilícium-dioxid által elfoglalt hányadát, és így meghatározták a vizes oldat térfogatának és a teljes Percoll törzsoldat térfogatának arányát.
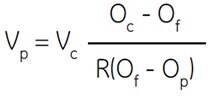
Hol:
Vp = a hozzáadandó Percoll részek száma
Vc = az oldott anyag koncentrátum részek száma (pl.pl. 1,5 M NaCl), amelyet hozzá kell adni
Oc = az oldott koncentrátum ozmolalitása (pl. 1.5 M NaCl = 2880 mOsm)
Of = a kívánt ozmolalitás
R = a vizes térfogat és a Percoll teljes térfogatának aránya (NaCl esetén jellemzően = 0,85, NaCl esetén 0,85).80 a szacharóz esetében)
Op = a hígítatlan Percoll ozmolalitása (analitikai bizonyítvány)
A kulcsváltozó ebben az egyenletben az R, amely a Percoll-oldat valós víztérfogatának mértékegysége. Az R értéke a Percoll-részecskék által elfoglalt hidrodinamikai térfogat függvénye. Ez viszont a közeg ionerősségének függvénye; vagyis az ionerősség növekedésével a hidrodinamikai térfogat csökken. Így az 1,5 M NaCl és a 2,5 M szacharóz R értéke között különbség van.
Az 1,5 M NaCl-lal (azaz 10× koncentrált fiziológiás sóoldattal) beállított SIP ozmolalitás = 320 mOsm/kg H2O értékének eléréséhez:

feltételezve:
2880 = 1 osmolalitás.5 M NaCl
(10× koncentrált fiziológiás sóoldat)
20 = a Percoll hígítatlan ozmolalitása
Ezért ahhoz, hogy 320 mOsm/kg H2O SIP-t kapjunk, 10 rész Percollt kell hozzáadni 1 rész 1,5 M NaCl-hoz.
Az ozmolalitás hatása a sejtek és a szubcelluláris részecskék látszólagos felhajtóerő sűrűségére
A Percoll nagyon alacsony ozmolalitása megkönnyítette az elválasztóközeg ozmolalitásának és a részecskék látszólagos felhajtóerő sűrűségének összefüggésének vizsgálatát. A 6. ábra mutatja a patkánymáj májhepatociták 200, 300 és 400 mOsm/kg H2O ozmolalitású Percoll-gradiensben történő sávozásának hatásait. A sejtek látszólagos úszósűrűsége az ozmolalitás növekedésével nő, a sejtekből történő vízelvonás miatt. Ugyanezt a hatást figyeltük meg a mitokondriumok (7. ábra) és a lizoszómák (1. táblázat) esetében is. Az ozmolalitásban bekövetkező kis változások is nagy változást okoznak ezen organellumok látszólagos úszósűrűségében. A Percoll-grádiensben fiziológiás ozmolalitás mellett sávozott részecskék tényleges regisztrált úszósűrűsége ezért sokkal inkább megfelel az in vivo létezőnek, mint amikor a részecskéket szacharózban vagy más centrifugálási közegben sávozzák.

6. ábra.Patkánymáj hepatociták sejtjeinek frakcionálása (35 × 106 sejt 2 ml térfogatban) saját előállítású Percoll-gradiensben (8 ml oldat, 1,065 g/mL sűrűséggel). A Percoll-oldat ozmolalitását NaCl hozzáadásával 200 mOsm, 300 mOsm és 400 mOsm értékig változtattuk. A centrifugálást Beckman 30.2 rotorban végeztük 15 percig 35 000 × g-nél, 4 °C hőmérsékleten. A sűrűséggradienst a Density Marker Beads (23. oldal) (27, a szerzők és a kiadó szíves engedélyével sokszorosítva) segítségével határoztuk meg.

7. ábra. Patkánymájsejtek mitokondriumainak sűrűségeloszlása izo-ozmotikus pufferben (piros) és 17,5% albumint tartalmazó pufferben (zöld) történő inkubáció után. A centrifugálásokat Beckman 65 rotorban (23°-os szögben) végeztük 30 percig 40 000 × g-nél (59, a szerzők és a kiadó szíves engedélyével reprodukálva).
Patkány hepatocitákból származó lizoszomális frakciót nyertünk vissza Percoll/0,25 M szacharóz gradiensből 1,0-1,05 g/ml sűrűséggel, és a táblázatban leírt közegben inkubáltuk 1 órán keresztül 37 °C-on. Ezt követően a felhajtó sűrűséget Percoll/0,25 M szacharóz gradiensben határoztuk meg újra (27, a szerzők és a kiadó szíves engedélyével sokszorosítottuk).
A gradiens kialakulását és alakját befolyásoló tényezők
Noha a Percoll részecskék hidratált térfogata 0,15 M NaCl jelenlétében kisebb, mint Percoll/0,25 M szacharózban, a részecskék szedimentációs sebessége gyorsabb a Percoll sósavban való kisebb viszkozitása miatt. Így, ha a Percollt 0,15 M sóoldattal vagy ezzel egyenértékű ionerősségű szövettenyésztő közeggel izoozmotikusan állítjuk elő, akkor körülbelül 2-3-szor gyorsabban képez öngenerált gradienst, mint a 0,25 M szacharózzal izoozmotikusan előállított, egyenértékű Percoll-oldat.
A centrifugálás és az idő összefüggnek egymással, mivel a gradiens alakját a (g erő) × (idő) összeg határozza meg. A 0,15 M sóoldatban lévő Percoll esetében legalább körülbelül 10 000 × g-t, a 0,25 M szacharózban lévő Percoll esetében pedig körülbelül 25 000 × g-t kell alkalmazni a gradiensek öngenerálásához a szögfejes rotorokban. A rotor geometriája jelentősen befolyásolja a gradiens alakját adott körülmények között, amint azt a 8. ábra mutatja. Ahogy a szög közelít a függőlegeshez, a gradiens kialakulásához szükséges út hossza rövidebb lesz, és a gradiens gyorsabban alakul ki. A 9. és 10. ábra azt mutatja, hogy a Percoll kezdeti koncentrációja is hatással van a kialakult gradiens alakjára.

8. ábra.A rotor szögének hatása a gradiens kialakulására Percoll használatával. A kiindulási sűrűség 1,065 g/ml volt 0,15 M NaCl-ban. Futtatási feltételek: 30 000 × g 14 percig. A színes vonalak a színes Density Marker Beads (45, a szerzők és a kiadó szíves engedélyével sokszorosítva) helyzetére utalnak.
A függőleges rotorokban végzett centrifugálás nagyon gyorsan Percoll-gradienseket képez. Ügyelni kell azonban arra, hogy a nagy sebességű centrifugálási körülmények között esetlegesen képződő, tömörített Percoll pellet ne szennyezze a gradienst a frakcionálás során.
A lengőkosaras rotorok használata a gradiensek öngenerálására nem ajánlott a hosszú út hossza és a cső mentén fellépő egyenlőtlen g-erő miatt. Jenkins és munkatársai (személyes közlés és 87. hivatkozás) azonban beszámolnak bizonyos előnyökről az ilyen típusú rotorok használatában a májorganellumok szubcelluláris frakcionálásához.
Zonális rotorok használhatók Percoll in situ gradiensek kialakítására. A zonális rotorokban kialakított gradiensek ugyanazokkal a jellemzőkkel rendelkeznek, mint a szögfejes rotorokban létrehozott gradiensek. A nagy mintatérfogat miatt ajánlott a nem zonális rotorban az elválasztási feltételeket empirikusan meghatározni, mielőtt a zonális rotorban történő méretnövelést elvégeznénk. Zonális rotorokat használtak vírusok nagyléptékű tisztítására (21) és lizoszómák szubfrakcionálására (24).
Az öngenerált gradiensekkel való munka megkezdésekor célszerű színes sűrűségjelölő gyöngyökkel (22. oldal) modellkísérletet végezni, hogy ismert körülmények között olyan standardgörbék sorozatát állítsuk elő, amelyek a későbbi kísérletekhez használt szögfejes rotorra jellemzőek.

9. ábra.Színes sűrűségjelző gyöngyök használata a gradiens alakzat megjelenítésére. A 0,15 M NaCl-ban lévő izotóniás Percoll törzs 90% és 20% között változó Percoll-oldatokból kialakított gradiensek. Futtatási feltételek 23°-os szögben álló rotor 30 000 × g, 15 perc.

10. ábra.Színes sűrűségjelző gyöngyök használata a gradiens formák megjelenítésére. A Percoll hígításai a 9. ábra szerint, a futtatási feltételek: 23°-os szögben álló rotor, 60 000 × g, 15 perc. A nagyobb g-erő miatt meredekebb gradiensek alakultak ki.
Diszkontinuus (lépcsős) gradiensek
A diszkontinuus gradiensek nagy rugalmasságot és könnyű használatot biztosítanak. Gyakran csak egy Percoll-párna vagy egyetlen lépés szükséges a célsejttípus kiváló dúsításához vagy felbontásához. Például a legtöbb vérsejt dúsítható diszkontinuus gradiensek segítségével (11. ábra).

11. ábra.Limfociták és monociták elválasztása Percollban végzett diszkontinuus sűrűségű centrifugálással. A Ficoll-Paque™-on izolált 1,5-2,0 × 107 PBMC-t (perifériás vér mononukleáris sejtek) 11,25 ml Percollban kevertük Hanks BSS-ben, amely 1% HEPES puffert tartalmazott (sűrűség = 1,080 g/mL), és az ábrán (69, a szerzők és a kiadó szíves engedélyével reprodukálva) látható lépések alatt alábontottuk.
A diszkontinuus gradiens kialakításához a SIP-et a 12. oldalon leírtak szerint különböző sűrűségű hígítással hígítják. A különböző sűrűségű oldatokat ezután gondosan egymásra rétegezzük a sűrűség sorrendjében, a legsűrűbbel kezdve a cső alján. Ez a legkényelmesebben egy pipetta vagy egy széles tűvel ellátott fecskendő segítségével végezhető el. Fontos, hogy az eszköz hegyét a cső falához szorosan a folyadék felszíne fölött tartsuk, hogy elkerüljük a "fröccsenést" és a keveredést a határfelületen. A sejtek éles sávjának kialakulása a határfelületen csak akkor következik be, ha a sűrűségben éles változás következik be.
A centrifugálást viszonylag kíméletes körülmények között, például 400 × g-vel 15-20 percig padon álló centrifugában végezzük. Ezek a kíméletes körülmények a sejtek izopiknikus sávosodását eredményezik a megfelelő határfelületeken. Az alacsony g-s körülmények és a rövid futási idő nem okozza a Percoll üledékképződést, és semmilyen módon nem befolyásolja a gradienst.
Folyamatos lineáris és nem lineáris gradiensek
A folyamatos gradienseket a sűrűség egyenletes változása jellemzi a cső tetejétől az aljáig. A diszkontinuus gradiensben jelenlévő nyilvánvaló határfelületek helyett a folytonos gradiens úgy képzelhető el, hogy végtelen számú határfelülettel rendelkezik. Ezért a sejtek izopiknikus sávosodása a sejtek pontos sűrűségénél következik be.
Egy ilyen gradiens kialakításához a SIP-et először felhígítják, hogy két ismert sűrűségű oldatot állítsanak elő a kívánt tartomány határán, majd egy kétkamrás gradiens készítővel összekeverik. A két kiindulási oldat határértékei közötti tartományt átfogó lineáris gradiens jön létre.
Egycsatornás perisztaltikus szivattyú egy gradiens keverővel kombinálva lineáris, domború és homorú gradiensek létrehozására használható, a használt csövek relatív átmérőjétől függően. A gradiens tetejétől az aljáig nagyon szűk sűrűségtartomány alakítható ki az életképes sejtek maximális felbontásának elérése érdekében. A nehezebb sejtek általában pelletálódnak, míg a nem életképes sejtek a gradiens tetején találhatók. Például az eritrociták pelletálódnak, ha a gradiens alján a sűrűség nem haladja meg az 1,08 g/ml értéket. A sűrűségjelölő gyöngyök külső jelölőként használhatók a mintacsőben lévővel azonos gradienst tartalmazó csőben.
Az elválasztáshoz szükséges centrifugálási feltételek ugyanazok, mint a diszkontinuus gradiensek esetében. A folyamatos gradienseken végzett elválasztásokra példa a Leydig-sejtek, laktotrófok, csontvelősejtek, bélhámsejtek, tengeri mikroalgák és kloroplasztiszok tisztítása.
Elkészített, öngenerált gradiensek
A gradiens centrifugálással történő elkészítése kényelmes alternatívája lehet a gradiens készítő vagy pumpa használatának. Amint azt korábban leírtuk, a Percoll jelentős g-erők (pl. > 10 000 × g) hatására leülepedik. A gradiens előkészítésekor a SIP-et olyan sűrűségre hígítjuk, amely annak a tartománynak a közepén helyezkedik el, amelyben a maximális felbontásra van szükség. Két centrifugacsövet töltünk meg gradiens anyaggal (az egyiket a kísérlethez, a másikat pedig a sűrűségjelölő gyöngyökkel). Ez a második cső egyrészt ellensúlyként, másrészt a gradiens ellenőrzésének külső módszereként szolgál. A csöveket egy szögfejes rotorban centrifugáljuk (pl. 30 000 × g 15 percig), és a gradiens izometrikusan alakul ki a kiindulási sűrűség körül (4. ábra). A gradiens viszonylag "lapos" régiójának a célsejtek maximális felbontásához szükséges tartományt kell felölelnie. Ez megerősíthető a gradiens alakjának megfigyelésével a sűrűségjelölő gyöngyöket tartalmazó csőben. A gradiens az idő múlásával fokozatosan meredekebbé válik. Kimutatták, hogy a gradiens alakja megközelítőleg lineárisan függ a centrifugálás teljes g-erejétől és idejétől.
A gradiens kialakítása után a sejtek izopiknikus sávozása alacsony sebességű centrifugálással végezhető el 15-20 percig 400 × g-nél. Ha a sejtsűrűség becslésére van szükség, a sejtszuszpenzióval megegyező térfogatot kell a Density Marker Beads-et tartalmazó cső tetejére rétegezni. Ez egyrészt a sejtsűrűség becslésére, másrészt ellensúlyozásra szolgál.
in situ
A szubcelluláris részecskék és a vírusok szedimentációs együtthatója általában túl alacsony ahhoz, hogy alacsony g-erőknél lehetővé tegye az előre kialakított gradienseken való sávozást. Ezért gyakran célszerű a biológiai részecskék szuszpenzióját Percollal keverni, és a részecskéket in situ kialakított gradiensre sávozni. A centrifugálással kialakított Percoll gradiensek metastabilak (azaz a nagy sebességű centrifugálás során folyamatosan változnak). A kolloid szedimentációs sebessége elég lassú ahhoz, hogy a in situ kialakuló gradiens során lehetővé tegye a kis vírusok és a sejtorganellumok "S" értékekkel > 60S sávozását.
A gradiensek in situ kialakításának gyakori módszere a SIP elkészítése, 9 rész Percoll és 1 rész 2,5 M szacharóz felhasználásával. A SIP-et ezután 0,25 M szacharózzal a kívánt sűrűségre hígítjuk. (Bár a in situ gradiensek készítéséhez jellemzően szacharózt használnak, sejttenyésztési közeg is használható). Ha a mintát közvetlenül gradiens anyaggal keverjük, a Percoll-oldat teljes sűrűségére gyakorolt hatás a 13. oldalon található képlet alapján kiszámítható. A minta előkeverése a gradiens anyaggal akkor célszerű, ha a részecskék felhajtóerejének pontos mérése kívánatos. Jobb lehet azonban a kísérleti mintát a gradiens anyagra rétegezni, különösen olyan esetekben, amikor a szubcelluláris részecskéket kívánjuk elválasztani az oldható fehérjéktől. Az oldható fehérjék a gradiens feletti pufferrétegben maradnak, a szubcelluláris részecskék pedig a Percoll-gradiensben in situ elkülönülnek.
A centrifugálást szögfejes rotorban kell végezni. A gradiens megfigyelésére a kísérleti minta helyett Density Marker Beads-t tartalmazó mérlegcsövet használunk. A 22. oldalon leírtakhoz hasonló, megfelelő modellkísérletet kell először elvégezni a használni kívánt rotor gradiensképzési jellemzőinek megállapítására.
Maximális mintaterhelés a Percoll-gradiensekhez
Nincsenek szabványos szabályok a Percoll-gradienseken elválasztható sejtek vagy szubcelluláris anyagok maximális mennyiségére vonatkozóan. Szubcelluláris frakcionálás esetén sikeres tisztítás érhető el 1-5 mg fehérje teljes terhelésével 0,5 ml mintatérfogatban 10 ml gradiens anyagon (Pertoft, személyes közlés).
Modellkísérlet a Percoll gradiensek feltételeinek standardizálására
A centrifugálás során kialakuló gradiensek pontos alakját és tartományát befolyásolja a használt rotor modellje és szöge, valamint a centrifugacsövek mérete. Az alábbi kísérlet célja, hogy lehetővé tegye egy adott rotorra és csövekre vonatkozó gradiensgörbe-sorozat létrehozását, és referenciaként használható minden jövőbeli kísérlethez.
A választott példa 10 ml-es gradiensre vonatkozik, de nagyobb csőméret esetén ez felskálázható.
- Keverjen össze 49,5 mL Percollt 5,5 mL 1,5 M NaCl-lal, hogy SIP-et készítsen.
- Keverjen össze SIP-et az 1. lépésből 0,15 M NaCl-lal, hogy 10 mL-es kísérleti minták sorozatát készítse el (teljes centrifugacsőméret = 13,5 mL) az alábbi táblázatban látható módon:
- Adjon 10 μL szuszpenziót minden egyes típusú sűrűségjelölő gyöngyből minden egyes csőbe a csomagolásban található utasításoknak megfelelően.
- Egyensúlyozza és zárja le a csöveket, majd többször megfordítva keverje össze őket.
- Tegye a csöveket a szögfejes rotorba (ha csak 8 hely van, hagyja ki az 1. és 10. csövet).
- Centrifugáljon 30 000 × g-n 15 percig.
- Óvatosan vegye ki a csöveket, és milliméteres grafikus papír segítségével mérje meg 0,5 mm pontossággal az egyes sávok távolságát a cső aljától.
- Plotálja a gradiens alakját minden egyes csőre úgy, hogy minden egyes sávot az egyes Marker-gyöngyök pontos úszósűrűségével kalibrál.
- Keverje újra össze az egyes csövek tartalmát inverzióval, és ismételje meg a centrifugálást, ezúttal 60 000 × g-vel 15 percig.
- Mérje meg a gradienseket, és ábrázolja az eredményeket az előzőekhez hasonlóan. Számítsa ki a hígítás pontos sűrűségét a képlet segítségével (13. oldal). A 9. és 10. ábra tipikus példákat mutat a 0,15 M NaCl-ban lévő Percoll segítségével készített görbék sorozatára.
A kísérlet megismételhető 0,15 M NaCl-ban lévő Percoll segítségével.25 M szacharózzal; ebben az esetben a futtatási körülményeknek 50 000 × g-nek kell lenniük 25 percig, majd 100 000 × g-nek 25 percig.
A percenkénti fordulatszám (RPM) relatív centrifugális erőre (RCF) vagy g-erőre történő átszámításához használja a G-erő-kalkulátor.
.Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?