Řešení problémů s RT-PCR
Na této stránce
- Vývoj protokolu pro řešení problémů
- Optimalizace návrhu oliga
- Optimalizace testu PCR
- RT-PCR a qPCR Assay Design
- Kvalita templátu RNA nebo DNA
- Program PCR analýzy
- Porucha termocykléru
- Příklady řešení problémů: Diagnostické nástroje
- Disociační křivky / křivky tání
- Případové studie řešení problémů s RT-PCR
- Souhrn - Kontrolní seznam pro řešení problémů s PCR
Vypracování protokolu pro řešení problémů s PCR nebo RT-PCR
Potenciální zdroje chyb a/nebo problémů Chyba obsluhy
Existuje mnoho možností chyby obsluhy. Zdroje těchto chyb často zůstávají neidentifikovány. Prvním krokem v každém postupu řešení problémů je kontrola protokolu a opakování experimentu. Důležitá je kontrola protokolu (viz Příloha A, Protokoly, této příručky) a požádání zkušeného molekulárního biologa o přezkoumání plánu experimentu. Varovný příběh postdoktoranda, který provedl několik neúspěšných PCR, než si uvědomil, že v PCR master mix je připomínkou, že i ti nejlepší přepracovaní vědci jsou náchylní k jednoduchým chybám.
Master mix
Chyby nebo problémy se směsí reakčních komponent master mixu mohou být zdrojem katastrofálního selhání amplifikace všech vzorků a pozitivních kontrol. Před opakováním experimentu zkontrolujte všechny složky a jejich koncentrace. Pokud se používá nová šarže činidla, je užitečným preventivním opatřením porovnat nové se starým před zahájením velké série experimentů.
Při změně produktů master mixu je důležité si uvědomit, že některé testy jsou obzvláště citlivé na kombinace složení pufru/teploty žíhání (Ta)/koncentrace primerů. Změna kterékoli z nich může vést k odlišnému výkonu. Proto před provedením radikálních změn ověřte všechny testy ve vybraných master mixech a na všech požadovaných přístrojích. Je také nezbytné prostudovat návod dodávaný s každou master směsí, protože v něm jsou uvedeny doporučené podmínky optimalizované pro daný enzym, mechanismus Hot Start a složky pufru.
Je správnou laboratorní praxí zajistit, aby bylo připraveno dostatečné množství reakční master směsi pro všechny vzorky, které mají být provedeny společně. Dbejte na to, aby byly všechny složky pečlivě rozmraženy a dobře promíchány a aby byla experimentální master směs před alikvotací do vzorků velmi dobře promíchána. To se týká zejména některých 2× pufrů, jako je KiCqStart® které jsou viskóznější než běžné PCR pufry.
Oligo optimalizace
Oligos mohou způsobit problémy, pokud jsou; nesprávné sekvence nebo špatně navržené, prováděné v neoptimální koncentraci, neoptimální Ta, nebo jsou nedostatečně označené nebo chlazené (u sond). Test prováděný za neoptimálních podmínek pro oligo nebo s použitím špatného návrhu může poskytnout určité údaje, které však nemusí odrážet skutečnou biologii. Po obdržení lyofilizovaného oliga je důležité:
- Ověřit sekvenci
- Zajistit, aby byla veškerá DNA před použitím resuspendována
- Potvrdit, že roztok má očekávanou koncentraci
Resuspendujte oligosy zahřátím na 90 °C po dobu 5 min a poté je dobře promíchejte. Opakované cykly rozmrazování mohou také ovlivnit výkonnost oliga, a proto by všechna oliga v zásobní koncentraci (obvykle 100 μM) měla být alikvotně odebrána a dlouhodobě skladována při -20 °C, případně -80 °C.
V průběhu fáze řešení problémů je velmi důležité ověřit, že byla objednána správná sekvence, a to tak, že se vrátíte k cílové sekvenci a potvrdíte, že sekvence oliga jsou skutečně přítomny. Ujistěte se, že kvalita oliga byla správná, kontaktováním dodavatele oliga. Změřte pracovní koncentraci oliga a vizuálně zkontrolujte fluorescenční molekuly, abyste potvrdili, že jsou označeny. Otestujte primery sondových testů ve směsi SYBR® Green I qPCR pro ověření amplifikace. Zvažte optimalizaci koncentrací primerů nebo Ta (viz Optimalizace a validace testu). Při prvním použití sondy shromážděte fluorescenční údaje pro co nejvíce potenciálních vlnových délek, aby bylo možné pozorovat případné úniky signálu mezi kanály a odhalit chyby ve značení.
Neadekvátní optimalizace PCR
Vliv optimalizace testu byl popsán a demonstrován v Optimalizace a validace testu. Pokud test selhává nebo funguje suboptimálně, ale v jeho návrhu nebo pracovních postupech nejsou žádné chyby, může být přínosem optimalizace experimentálních podmínek. Při řešení problémů otestujte primery při 100 nM, 500 nM a 900 nM konečné koncentraci a/nebo Ta mezi 55 °C až 70 °C (pomocí teplotního gradientu), abyste zjistili, zda se test zlepší další optimalizací.
RT-PCR a qPCR Assay Design
Návrh testu byl popsán v PCR/qPCR/dPCR Assay Design. Při řešení problémů s analýzou se ujistěte, že byl návrh ověřen. Ověřte, že primer PCR/qPCR a pozice amplikonu jsou v souladu s protokolem primingu RT. Například se ujistěte, že testy použité na cDNA, která byla připravena po oligo-dT primingu, jsou umístěny směrem k 3' transkriptu. Ujistěte se, že informace o sekvenci jsou spolehlivé a že byly zohledněny příslušné sestřihové varianty a SNP.

Obrázek 11.1A.Test má neobvyklý profil amplifikačního diagramu s výrazným driftem základní linie.

Obrázek 11.1B.Sekvence sondy, která byla zahrnuta do testu, byla zadána do softwaru mfold pro predikci skládání. Je zřejmé, že sonda mohla v roztoku zaujmout stabilní složenou strukturu, což pravděpodobně vedlo k pozorovanému problému.
Kvalita šablony RNA nebo DNA
Vliv kvality šablony na výkonnost testu byl popsán v Purifikace vzorků a hodnocení kvality. Kvalita vzorku zahrnuje posouzení množství, integrity a přítomnosti inhibitorů. Je velmi důležité zajistit, aby kvalita RNA odpovídala nejvhodnějšímu protokolu primingu RT (viz Reverzní transkripce) a použít co nejkvalitnější šablonu. Stejně tak množství RNA, které se přidává do reakcí RT, musí být v rozsahu protokolu a v mnoha případech by mělo být stejné pro všechny reakce. ReadyScript® je významnou výjimkou z tohoto pravidla, protože přijetí tohoto činidla a protokolu vede k lineární koncentraci cDNA, která je úměrná množství vstupní RNA. Při řešení problémů se vzorkem, který poskytuje vyšší než očekávané Cq, proveďte test SPUD nebo vzorek zřeďte v ředicí sérii 1:5 nebo 1:10 a opakujte test (obrázek 11.2), abyste identifikovali vzorky, které obsahují inhibitory.


Obrázek 11.2.Amplifikace desetinásobného sériového ředění DNA templátu. Replikace jsou přesné, ale ΔCq je nekonzistentní a s rostoucím ředěním klesá. Údaje také ukazují pozitivní signál v kontrole bez templátu (NTC), což naznačuje kontaminaci nebo tvorbu dimerů primerů, a že ředění na méně než 105 kopií mají shodné údaje s NTC.
Důležitým faktorem je také množství šablon. Zařazení příliš velkého nebo příliš malého množství templátu do PCR bude mít za následek neúspěšné reakce a amplifikační grafy qPCR, které budou vypadat abnormálně. Obrázek 11.3A ukazuje reakci obsahující desetinásobné sériové ředění umělého oligo templátu. Nižší ředění jsou příliš koncentrovaná na to, aby reakce byla účinná nebo aby přístroj efektivně zpracoval základní data (obrázek 11.3B), což vede k abnormálním amplifikačním grafům a nespolehlivým datům.

Obrázek 11.3. A)Amplifikace desetinásobného sériového ředění umělého templátu pomocí specifických primerů a sondy značené FAM. Cq je u koncentrovaných vzorků velmi nízké, amplifikační grafy nejsou pravidelně rozloženy a jsou abnormální. B) Zobrazuje nezpracované údaje pro tyto amplifikační grafy. Reakce obsahující nejvyšší koncentraci terče mají také výrazně vyšší fluorescenci pozadí a minimální výtěžek fluorescence v průběhu reakce.
Program PCR
Podmínky cyklování PCR musí být vhodné jak pro daný experiment, tak pro daná činidla (např, viz Master Mix). Přijetí výchozího nastavení přístroje bez ověření není vhodné.
Porucha tepelného cykléru
Poruchy přístroje mohou mít zákeřný začátek, a proto mohou být obtížně diagnostikovatelné. Abyste předešli nákladným nákladům na opravu, zajistěte, aby všichni operátoři přístrojů byli plně vyškoleni a zpočátku pod dohledem. Některé závady přístrojů způsobují katastrofické poruchy, jejichž výsledkem je absence amplifikace nebo fluorescenčních dat, zatímco jiné zkreslují data nebo zpracovávají vzorky nejednotným způsobem a vytvářejí umělé rozdíly mezi identickými biologickými vzorky. Použití kontrolních vzorků s kontrolními testy je pro řešení problémů neocenitelné. Při podezření na závadu přístroje by měl být ve všech jamkách proveden spolehlivý, optimalizovaný test. Tato kontrola uniformity odhalí problémy, které jsou specifické pro oblasti přístroje, i samostatné problémy s testem a přístrojem.
Příklady řešení problémů PCR demonstrující použití diagnostických nástrojů
Po spuštění dobře naplánované PCR je k dispozici několik diagnostických nástrojů pro řešení problémů:
- Kontrolní vzorky a testy
- Koncový gel/barvicí činidlo SYBR Green I
- Amplifikační grafy (kontrola replikátů a profilu amplifikačního grafu)
- Standardní křivky (gradient a R2)/řady ředění
- Kresby tání/disociace (barvivo SYBR Green I, molekulární majáky, Scorpions® sondy)
- Zobrazení surových dat/multikomponent
Kontrolní vzorky/reakce
Důrazně se doporučuje používat kontrolní vzorky. Je téměř nemožné vyřešit neúspěšnou analýzu bez informací z vhodného souboru kontrol.

Obrázek 11.4. A)Neředěný templát neamplifikuje, zatímco ředění vykazuje lepší účinnost amplifikace. B) Přídavek 0,3 % BSA do směsi qPCR podporuje amplifikaci z neředěného templátu.
Vyšetřování zcela neúspěšného testu může být obtížné, protože pro řešení problémů je k dispozici jen málo informací. Vzhledem k tomu, že mnoho selhání testu je důsledkem nějaké katastrofické chyby, mělo by být první kontrolou ověření nastavení experimentu a následné opakování PCR. Pokud se to nepodaří, je postup řešení problémů závislý na informacích týkajících se jednotlivých složek experimentu (obrázek 11-5).

Obrázek 11.5.Základní postup řešení problémů s PCR.
Pokud experiment qPCR zcela selže, je třeba nejprve zkontrolovat návrh testu, sekvence oliga a údaje o kontrole kvality od výrobce oliga. Přestože test mohl selhat, lze k získání dalších informací použít multikomponentní/surová data qPCR. Obrázek 11.6A ukazuje graf surových dat pro dva testy obsahující buď sondu značenou 6-FAM™, nebo HEX™ (VIC®). Ačkoli oba testy vykazují amplifikaci, signál HEX je přibližně poloviční oproti signálu FAM. Vzhledem k tomu, že se jedná o přirozeně slabší barvivo, je to normální pozorování. Analýza agarosového gelu (obrázek 11.6B) ukazuje, že obě reakce poskytují podobnou koncentraci produktů, což podporuje pozorování, že hodnoty Cq qPCR jsou podobné.

Obrázek 11.6. A)Grafy nezpracovaných dat duplexního testu obsahujícího sondu značenou FAM a HEX. Sonda FAM přirozeně poskytuje vyšší fluorescenci. B) Agarózový gel, který ukazuje, že v každé reakci vzniklo stejné množství produktu, a potvrzuje pozorování qPCR Cq.
Prohlídka nezpracovaných dat je užitečnou kontrolou, zda je sonda správně označena a zda byla přidána do reakce. Obrázek 11.7 ukazuje nezpracovaná data pro amplifikaci tří cílů v triplexovém experimentu. Sondy specifické pro každý cíl jsou označeny značkami FAM, HEX a TAMRA. Sondy HEX a TAMRA vykazují nízké pozadí a účinnou amplifikaci, avšak signál FAM je po celou dobu experimentu trvale vysoký a není zde žádný důkaz amplifikace. To odpovídá příliš vysoké koncentraci sondy v reakci nebo chybě sondy, takže nedochází k počátečnímu zhášení signálu. V takových případech je třeba ověřit koncentraci sondy a návrh testu, zajistit, aby sonda měla kompatibilní značku a zhášeč, a případně otestovat novou sondu.
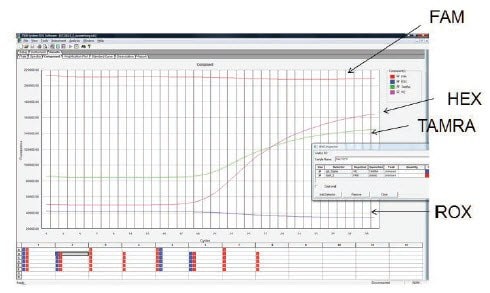
Obrázek 11.7.K detekci tří cílů byla použita triplexová reakce s použitím sond značených FAM, HEX a TAMRA. Sondy HEX a TAMRA poskytly amplifikaci z cílů, ale sonda FAM nevykazovala amplifikaci. Zkoumání nezpracovaných dat ukázalo, že fluorescence pozadí byla mimořádně vysoká a v průběhu reakce nebyl pozorován žádný rozdíl. To odpovídá příliš vysoké koncentraci sondy v reakci nebo vadné sondě s nedostatečným zhášením.
Pokud byl původní experiment založen na detekci sondou, je třeba test zopakovat s použitím činidel SYBR Green I, včetně pozitivní a negativní kontroly (nikoli však vzácných vzorků). Případně lze produkty neúspěšné reakce zkontrolovat na agarózovém gelu obarveném ethidiumbromidem. Přijetí přístupu SYBR Green I pro opakování pokusu je vhodnější, protože se vyhne riziku kontaminace a poskytne opakovaný pokus pro ověření původního neúspěchu. Pokud experiment SYBR Green I poskytuje údaje, je možné, že původní selhání sondy bylo způsobeno buď technickou chybou, nebo závadou sondy. Chcete-li rozlišit mezi experimentální chybou nebo závadou sondy, zopakujte experiment se sondou; pokud reakce opět selže, vyměňte sondu. Tento přístup lze použít při zkoumání reakcí, které poskytují špatné údaje. V příkladu uvedeném na obrázku 11.8 byla reakce se sondou neoptimální a při porovnání s reakcí provedenou pomocí SYBR Green I je vidět, že signál sondy neodráží experiment. V takových případech je třeba ověřit návrh testu a otestovat novou sondu.

Obrázek 11.8.Byly provedeny identické reakce obsahující buď qPCR sondu, nebo barvivo SYBR Green I (podle označení). Reakce se SYBR Green I byla přibližně o jedenáct cyklů citlivější a poskytovala mnohem vyšší fluorescenci na konci reakce. To svědčí o chybě v sondě nebo o problému s návrhem sondy (údaje laskavě poskytl Prof. Stephen Bustin, UK).
Ověření značení sondy
Zpracovaná data nebo vícesložkový graf jsou užitečným diagnostickým nástrojem pro zkoumání, zda byla do reakce zařazena vhodná koncentrace sondy a zda je sonda dostatečně značená a zhášená. Obrázek 11.9 ukazuje vícesložkový graf pro reakci obsahující tři sondy. První dvě vytvářejí amplifikační grafy a je patrná fluorescence pozadí. Ze třetí sondy nejsou žádné údaje a zkoumání nezpracovaných údajů ukazuje, že fluorescence pozadí odpovídá slepé kontrole s vodou, která neobsahuje žádnou sondu. Proto jsou tyto údaje výsledkem nepřítomnosti fluorescence v reakci. To by mohlo být způsobeno chybou při nastavování, při kterém nebyla zahrnuta sonda, nebo tím, že sonda nebyla označena.

Obrázek 11.9.Ve stejném vzorku byly detekovány tři geny. Dvě reakce vedly k amplifikaci (1 a 2), třetí reakce však byla negativní. Zkoumání vícesložkového zobrazení ukazuje, že fluorescence pozadí pro 3. reakci odpovídá vodní kontrole, což naznačuje nepřítomnost signálu.
Další kontrolu značení sondy lze provést pomocí štěpení DNázou I. Tu je třeba provádět s maximální opatrností, aby se zajistilo, že zásoby sond a primerů nebudou kontaminovány enzymem, což by vedlo ke katastrofálním výsledkům. Alikvotní část selhávající sondy (obrázek 11.10A) odpovídající množství obsaženému v reakci, např. 300 nM, se inkubuje s DNázou I a bez ní. To lze provést v reálném čase (obrázek 11.10B) tak, že se měří výtěžek fluorescence v závislosti na čase, nebo případně počáteční a koncový bod (po 10 min) odečtu poskytují dostatečnou informaci. Při provádění této zkoušky je důležité porovnat údaje s dobře fungující sondou, která má stejnou fluorescenční značku a zhášeč (obrázek 11.10B).

Obrázek 11.10. A)Pomocí různých sond byly detekovány dva templáty, oba značené FAM. Zatímco detekce pomocí jedné sondy vedla k vysokému fluorescenčnímu signálu, druhá sonda byla mnohem slabší. B) Kontrolní a testovací sonda (300 nM) byly inkubovány při teplotě 37 °C v přístroji reálného času v pufru DNázy I v přítomnosti nebo nepřítomnosti enzymu DNázy I. Uvolnění fluorescence ze sondy 1 bylo přibližně dvakrát větší než ze sondy 2, což ukazuje, že značení sondy 2 bylo nedostatečné.
Amplifikační grafy
Struktura amplifikačních grafů a reprodukovatelnost technických replikátů poskytují řadu informací o kvalitě testu qPCR a mohou také poskytnout první varovné signály, že vše není tak, jak má být. Amplifikační grafy na obrázku 11.11A jsou netypické, velmi zašuměné a bylo by obtížné je přesně interpretovat. Další zkoumání hodnot fluorescence dR ukazuje, že výtěžek fluorescence v koncovém bodě je pouze 400 jednotek, což naznačuje, že reakce je nedostatečná, ale amplifikační grafy byly vytvořeny softwarem přístroje a autoscalovány. Podobně data na obrázku 11.11B mají na začátku profilu výrazný liščí ohon (klesající křivka), než se po základním úseku opět zvýší. Vzhled liščího ohonu je konzistentní u dvou reakcí, ale jedna reakce má mnohem nižší koncový bod (obrázek 11.11C), což má za následek zesílený, relativní liščí ohon.
Obrázek 11.11. A) Amplifikační grafy, které jsou zašuměné v důsledku automatického škálování špatných dat softwarem přístroje s nízkou fluorescencí. B) Reakce poskytující nízký koncový bod dR mají výrazný počáteční liščí ohon. C) Liščí ohon se jeví jako normální efekt, pokud je v poměru k vysoké kvalitě testu.
Podobně jsou amplifikační grafy na obrázku 11.12A zjevně abnormální a nemohly být použity tak, jak jsou prezentovány. Amplifikační graf, který klesá pod nulu dR (obrázek 11.12A), je klasickou známkou toho, že bylo použito nevhodné nastavení základní linie. Zkoumání nezpracovaných dat pro tuto reakci (obrázek 11.12B) ukazuje, že skutečné amplifikační grafy mají normální profil, což potvrzuje, že analyzovaná data jsou výsledkem softwarového problému přístroje. Příslušnou základní linii lze odvodit ze surových dat a použít v softwaru. V tomto případě představují cykly 6 až 16 počáteční lineární, základní fázi reakce a po jejich použití jsou výsledkem normální amplifikační grafy (obrázek 11.12C).

Obrázek 11.12. A)Amplifikační grafy byly zřetelně abnormální, přičemž část profilu klesala pod základní linii. B) Zkoumání grafu nezpracovaných dat ukazuje, že reakční data odpovídají očekávání. C) Nastavení základní linie přístroje podle příslušných cyklů obnoví normální profil dat analyzovaných amplifikačních grafů.
Profil amplifikačního grafu lze také interpretovat a získat tak informace o kvalitě testu a optimalizaci. Obrázek 11.13 ukazuje pokus o amplifikaci desetinásobného sériového ředění templátu s každou koncentrací provedenou v duplikátu qPCR. Reprodukovatelnost mezi replikáty je špatná, rozdíl cyklů (ΔCq) mezi daty není konstantní a není 3,323 cyklu, jak se očekává u 10násobného sériového ředění. Zkoumání amplifikačních grafů s přihlédnutím k tomu, že se jedná o standardní křivku, ukazuje, že test je nestandardní a nemohl být použit pro analýzu. Důvody by vyžadovaly další zkoumání, ale mohly by být důsledkem; špatného návrhu testu (viz PCR/qPCR/dPCR Assay Design), neoptimální podmínky testu (viz Optimalizace a validace testu) nebo špatné pipetování (opakovaný test).

Obrázek 11.13.Vzorek cDNA byl naředěn desetinásobným sériovým ředěním a specifický templát byl detekován pomocí duplicitní qPCR pro každé ředění. Replikáty jsou slabé, což naznačuje problém s pipetováním nebo s optimalizací testu.

Obrázek 11.14.Během standardní qPCR se data náhle prudce zvýší s netypickým profilem.

Obrázek 11.15.V případě klesajících nebo háčkovaných fluorescenčních grafů může být příčinou komplementární vlákno, které soutěží s primerem a/nebo sondou o žíhání s templátem. Ignorujte, pokud není ovlivněna Ct.
Disociační křivky / křivky tání
Analýza disociační křivky nebo křivky tání se provádí po qPCR a je nástrojem analýzy, který se používá ve spojení s barvivy vážícími DNA (jako je SYBR Green I) nebo nedegradujícími sondami, jako jsou Molecular Beacons nebo Scorpions® Probes, k ověření, zda byl amplifikován jediný produkt. Po amplifikaci PCR se výsledný amplikon inkubuje při zvyšujících se teplotách a změny fluorescenčního signálu se detekují podle toho, jak DNA přechází mezi dvouvláknovým a jednovláknovým stavem. Pokud reakce obsahuje jediný amplikon, ten se rovnoměrně rozpouští a graf dF/dT (rychlost změny fluorescence v závislosti na teplotě) ukazuje jediný pík. Zkoumání křivky tání je obzvláště efektivní v kombinaci s údaji z kontrol. Obrázek 11.16A ukazuje profil tání po qPCR pro sérii experimentálních testovacích vzorků, pozitivní kontrolu a kontrolu bez templátu. Profil tání pro zkušební vzorky je totožný s pozitivní kontrolou a každý z nich vykazuje jediný pík pro dF/dT. Profil tání pro kontrolu bez templátu má širší profil a nižší Tm. Obě tato pozorování jsou v souladu s přítomností dimerů primerů, která je patrná u negativní kontroly. To je potvrzeno použitím agarózového gelu obarveného ethidiumbromidem (Obrázek 11.16B), který rovněž ukazuje, že dimery primerů jsou patrné, když je templát přítomen v nízké koncentraci. To způsobuje nadhodnocení cílové hodnoty, pokud je detekována ve vzorcích s nízkou koncentrací cíle. Proto by měl být test optimalizován nebo nově navržen. Naproti tomu, obrázek 11.16C ukazuje, že profil tání produktu v kontrole bez templátu je totožný s profilem tání pozitivní kontroly a testovaného vzorku. To je jasným důkazem kontaminace kontroly bez templátu templátem během nastavení experimentu. Poslední příklad demonstruje rozpoznání amplifikace cíle z gDNA, která je přítomna ve vzorku cDNA (obrázek 11.16D). Amplikon získaný z gDNA je delší, a proto má
vyšší Tm než amplikon z cDNA.

Obrázek 11.16A.Pozitivní kontrola, testovací reakce a NTC byly amplifikovány a poté podrobeny post-PCR analýze tání. V NTC je patrný produkt, který se taví při nižší teplotě a s širším píkem tání, což odpovídá tvorbě dimeru primeru.

Obrázek 11.16B.Dimery primerů jsou patrné při rozlišení těchto vzorků na gelu (spolu s dalšími vzorky), přičemž tvorba dimerů primerů je nepřímo úměrná koncentraci vstupního templátu.

Obrázek 11.16C.Příklad použití analýzy křivky tání k identifikaci reakční kontaminace v NTC.
Obrázek 11.16D.Identifikace většího amplikonu, který vznikl při PCR gDNA.

Obrázek 11.17. A)A) profil tání a B) analýza reakce SYBR green I v agarózovém gelu. Ačkoli profil tání naznačuje produkty s různou Tm, obrázek gelu ukazuje, že je přítomen jediný amplikon. To svědčí o sekvenci amplikonu, která obsahuje oblasti bohaté na AT nebo GC nebo repetitivní prvek, což vede k nepravidelnému tání.
Sériové ředění šablony/standardní křivky
Bez ohledu na to, zda experimentální návrh zahrnuje požadavek na standardní křivku pro případnou kvantifikaci, je detekce sériového ředění vhodné šablony účinným přístupem k validaci testu a řešení problémů. Detekce sériového ředění umožňuje definovat experimentální lineární dynamický rozsah testu. Obrázek 11.18A ukazuje standardní křivku s datovými body s nízkou koncentrací, které neodpovídají lineárnímu profilu. Nejobvyklejším důvodem tohoto vzorce dat je, že se ve vzorcích o nízké koncentraci vytvořily dimery primerů (jak je znázorněno na obrázku 11.18B). Jedná se o standardní křivku vytvořenou z údajů uvedených na obrázku 11.2. Obrázek 11.18C ukazuje standardní křivku s vysoce koncentrovanými vzorky, které vypadávají z lineárního rozsahu. Nejobvyklejšími důvody jsou inhibice reakce šablonou nebo nevhodné nastavení základní linie.

Obrázek 11.18. A) Datové body týkající se nižších koncentrací cílové látky neleží na standardní křivce. B) To je typické pro reakci, jejímž výsledkem jsou dimery primerů, jak je znázorněno na obrázku. V tomto případě není pozorován nárůst Cq u vzorků s nízkou koncentrací.

Obrázek 11.18C.Vzorky s vysokou koncentrací templátu neleží na standardní křivce. To je typické pro reakce, které jsou inhibovány koncentrací templátu nebo v důsledku nesprávného nastavení základní linie.
Standardní křivka se také používá k měření účinnosti reakce v celém dynamickém rozsahu ředění. Je třeba dbát na to, aby všechny body použité pro výpočet účinnosti ležely na přímce. Reakce by měly být co nejblíže 100% účinnosti a reakce se zjevně vysokou (>110 %) nebo nízkou (<85 %) účinností by měly být dále zkoumány.

Obrázek 11.19A.Templátová nukleová kyselina byla naředěna v desetinásobné sérii. Amplifikační grafy mají abnormálně mělký gradient a ΔCq je 4 cykly místo očekávaných 3,3.

Obrázek 11.19B.K výpočtu účinnosti reakce se použije gradient standardní křivky závislosti Cq na množství.

Obrázek 11.20A.Templátová nukleová kyselina byla naředěna v desetinásobné sérii. ΔCq mezi amplifikačními plochami je 1,5 cyklu místo 3,3 cyklu.

Obrázek 11.20B.K výpočtu účinnosti reakce, která se blíží 140 %, se použije gradient standardní křivky závislosti Cq na množství.

Obrázek 11.20C.Zkoumání profilu křivky tání ukazuje, že vzorky s nižší koncentrací (žluté a modré stopy) obsahují také signál z amplifikovaných dimerů primerů (pík při nižším Tm).
Troubleshooting RT-PCR Case Studies
Selhávající test se sondou
Test se sondou byl navržen pro detekci EIFB1 ve vzorcích lidské cDNA, ale nevykazuje žádnou amplifikaci. Počáteční reakce byly provedeny na přístroji ABi StepOne s použitím kompatibilních činidel. Byl proveden pokus o optimalizaci primerů s použitím rozsahu koncentrací od 200 nM do 900 nM (obrázek 11.21), ale bez zlepšení. Návrh testu byl ověřen a shledán vhodným pro daný cíl a in silico bylo předpovězeno, že se jedná o vysoce kvalitní test. Byly syntetizovány nové primery a provedeny spolu s alikvotem původní syntézy za použití jiného operátora, činidel SYBR Green I (tedy jiných činidel) a přístroje (Eppendorf Realplex) (obrázek 11.22). Při volbě tohoto přístupu jsme měli na paměti, že primárním cílem bylo vyřešit problém, zatímco sekundárním cílem bylo vysvětlit selhání. Tato reakce poskytla ekvivalentní amplifikaci z obou dávek primerů. V této fázi se zdálo, že problém reakce spočívá v sondě, a proto byla syntetizována nová sonda a obě šarže byly porovnány druhým operátorem na přístroji Realplex za použití činidel LuminoCt® (jiná činidla než ta, která byla původně vyzkoušena) (obrázek 11.23). Obě sondy poskytly údaje o amplifikaci, přičemž nová sonda se jevila o něco lepší než původní, i když je třeba poznamenat, že původní sonda byla posílána mezi testovacími laboratořemi, a proto byla při pokojové teplotě, v roztoku několik dní. V této fázi bylo zřejmé, že jak původní, tak náhradní sonda fungují, když je druhý operátor spustí v činidlech LuminoCt® na přístroji Realplex.
Zbývající příčiny původního selhání byly proto považovány za:
- Operátor: pokus byl několikrát opakován zkušeným vědcem, a proto byl tento důvod považován za nepravděpodobné vysvětlení.
- Přístroj: mohl mít nějaké problémy, protože některé jiné testy selhaly.
- Reagencie: nejjednodušší vysvětlení k otestování. Reagencie LuminoCt® byly porovnány se stávajícími reagenciemi s použitím obou šarží oliga na přístroji ABi StepOne, a to prvním operátorem. Reakce s původními činidly selhala, ale s činidly LuminoCt® došlo k dobré amplifikaci (obrázek 11.24).

Obrázek 11.21.Primery pro EIFB1 byly testovány v koncentracích od 200 nM do 900 nM. Za žádných podmínek nebyla pozorována amplifikace (oligos a činidla ABi na přístroji ABi StepOne Plus).

Obrázek 11.22.V činidle SYBR Green I byly porovnány dvě dávky primerů pro EIFB1; původní neúspěšná dávka a nová dávka. (oligos a reagencie na přístroji Eppendorf Realplex). Obě sady primerů podporovaly amplifikaci.

Obrázek 11.23.V činidle LuminoCt® byly porovnány dvě šarže primerů a sond pro EIFB1; původní neúspěšná šarže a nová šarže. (oligos a reagencie na přístroji Eppendorf Realplex). Obě sady olig podpořily amplifikaci.

Obrázek 11.24.Test primeru a sondy EIFB1 byl proveden ve dvou různých činidlech (originální ABi nebo činidlo LuminoCt®). Údaje z tohoto testu byly získány pouze při použití činidel LuminoCt®.
Účinnost reakce byla nesprávná a proměnlivá
Test byl proveden na sériovém ředění umělého oliga pomocí standardního testu primerů a sond. Test byl původně vyvinut a optimalizován na jiném přístroji, ale při přenosu do jiné testovací laboratoře a na jiný přístroj se neočekával zvláštní efekt ředění (obrázek 11.25A). Všechny podmínky testu byly znovu optimalizovány tak, aby byly specifické pro novou laboratoř, ale bez změny údajů. Provozovatel pozoroval, že účinek byl výraznější, když byl test opakován během několika hodin za použití stejné série ředění. V rámci procesu řešení problémů byla analýza provedena na jiném přístroji jiným operátorem, který opět vytvořil očekávanou standardní křivku. To vedlo k domněnce, že původní problém byl způsoben chybou obsluhy, selháním přístroje nebo nějakou jemnou odchylkou v experimentálním postupu. Vzhledem k tomu, že oba operátoři jsou velmi zkušení a přístroj fungoval dobře i při jiných experimentech, byla prozkoumána možnost jemných rozdílů. Důležitým vodítkem bylo pozorování variability údajů ze stejné série ředění po určité době skladování vzorků při 4 °C (obrázky 11.25A a 11.25B). To vedlo ke zkoumání zkumavek použitých pro ředicí série a k testu alternativ. Po přechodu na reakční zkumavky Eppendorf o objemu 1,5 ml pro ředicí série byla vytvořena předpokládaná standardní křivka (obrázek 11.25C), což ukazuje, že pro PCR je nezbytné zvolit plastové nádobí pro molekulární biologii s nízkou retencí a že tyto testy jsou citlivé na nepatrné odchylky v protokolu.

Obrázek 11.25A.Umělý oligo templát byl desetkrát naředěn a detekován pomocí specifického testu založeného na sondě. Mezi amplifikačními grafy jsou nekonzistentní rozdíly.

Obrázek 11.25B.Umělý oligo templát byl desetkrát naředěn (jedná se o ředění, která jsou detekována na obrázku 11.25A) a ponechán při teplotě 4 °C po dobu několika hodin, než byl detekován pomocí specifického testu založeného na sondě. Mezi amplifikačními grafy jsou nekonzistentní rozdíly, které jsou zhoršeny dobou mezi ředěním a testováním.

Obrázek 11.25C.Umělý oligo templát byl desetkrát naředěn do zkumavek molekulárně biologické kvality a detekován pomocí specifického testu založeného na sondě. Mezi amplifikačními grafy jsou podle očekávání konzistentní rozdíly.
Summary - Kontrolní seznam pro řešení problémů s PCR
- Zkontrolujte kvalitu vzorku (znehodnocený materiál způsobí chybné výsledky).
- Zkontrolujte, zda je protokol RT kompatibilní s návrhem (např, RT s primedem Oligo-dT musí mít v 3' 1 kb sekvence qPCR test).
- Zkontrolujte návrh testu.
- Zkontrolujte všechny kontroly.
- Zkontrolujte primery pomocí barviva SYBR green I/projeďte gel.
- Zajistěte správné nastavení softwaru (základní linie, detekce barviva, koncentrace pro standardy).
- Zajistěte, aby koncentrace ROX byla použitelná pro přístroj (a nerušila multiplex).
- Zkontrolujte úroveň fluorescence pozadí.
- Zkontrolujte značení sondy pomocí testu DNázy I nebo opakujte syntézu sondy.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?