Test enzymatyczny peroksydazy (EC 1.11.1.7)
Opis
Ta procedura służy do oznaczania aktywności enzymatycznej peroksydazy przy użyciu pirogallolu jako substratu. Produkty wykorzystujące tę metodę obejmują między innymi: P1709, P2088, P2088.P6140,P6782,P8125, P8170, P8250, P8375, P8415, oraz P8651.
Ciągłe spektrofotometryczne oznaczanie szybkości (A420, droga światła = 1 cm) opiera się na następującej reakcji:

Definicja jednostki: Jedna jednostka peroksydazy utworzy 1,0 miligram purpurogaliny z pirogallolu w ciągu 20 sekund przy pH 6,0 w temperaturze 20 °C. Jednostka ta jest równoważna ~18 jednostkom µM na minutę w temperaturze 25 °C.
Środki ostrożności
W celu uzyskania informacji dotyczących zagrożeń i bezpiecznego obchodzenia się z preparatem należy zapoznać się z Kartą Charakterystyki Substancji Niebezpiecznej.
Wymagane odczynniki i sprzęt
1.0 M jednozasadowy roztwór fosforanu potasu (Numer katalogowy P8709)
1.0 M dwuzasadowy roztwór fosforanu potasu (Numer katalogowy P8584)
Nadtlenek wodoru, 30% (w/w) roztwór (Numer katalogowy H1009)
.Pirogallol (Numer katalogowy 254002)
Kuwety i termostatowany spektrofotometr
Instrukcje przygotowania (przechowywanie/stabilność)
Do przygotowania odczynników należy używać ultraczystej wody (oporność ≥18 MΩ×cm w temperaturze 25 °C).
Bufor fosforanowy (100 mM bufor fosforanu potasu, pH 6,0 w 20 °C) - Dodaj 17,36 ml 1.0 M roztworu jednozasadowego fosforanu potasu (numer katalogowy P8709). Dodaj 2,64 ml 1,0 M dwuzasadowego roztworu fosforanu potasu (numer katalogowy P8584) i dostosuj do końcowej objętości 200 ml przy użyciu ultraczystej wody. Dostosować do pH 6,0 w temperaturze 20 °C przy użyciu 1 N KOH lub 1 N HCl. Przechowywać bufor fosforanowy na lodzie.
Roztwór nadtlenku (0.50% [w/w] roztwór nadtlenku wodoru [H2O2]) - Przygotuj rozcieńczenie 1:60 używając Hydrogen Peroxide, 30% (w/w) Solution (Numer katalogowy H1009) w ultraczystej wodzie.
Uwaga: Przygotuj świeże rozcieńczenia dla kontroli i próbki i przechowuj roztwór w zamkniętej fiolce 4 dram w lodzie, aby zmniejszyć ekspozycję na powietrze.
Roztwór pirogallolu (5% [w/v] roztwór pirogallolu) - Przygotuj roztwór 50 mg/ml używając .Pyrogallol (numer katalogowy 254002) w ultraczystej wodzie w bursztynowej fiolce (lub przykryć folią).
Uwaga: Przygotuj świeży roztwór i przechowuj go w lodzie, chroniąc przed światłem.
Roztwór peroksydazy - Przygotuj 10 mg/ml roztwór peroksydazy w zimnym buforze fosforanowym. Bezpośrednio przed użyciem przygotować roztwór roboczy zawierający 0,45-0,75 jednostki/ml peroksydazy w ZIMNYM buforze fosforanowym.
Uwaga: Roztwór podstawowy 10 mg/ml może być użyty do oznaczenia współczynnika RZ.
Procedura
Końcowe stężenia testu - W mieszaninie reakcyjnej 3.00 ml mieszaniny reakcyjnej, końcowe stężenia wynoszą 14 mM fosforanu potasu, 0,027% (v/v) nadtlenku wodoru, 0,5% (w/v) pirogallolu i 0,45-0,75 jednostki peroksydazy.
Uwaga: Używaj jednej kuwety na raz, ponieważ maksymalna szybkość jest w pierwszej minucie.
1. Odpipetuj następujące odczynniki do odpowiednich kuwet:
2.
2. Wymieszać przez odwrócenie i wyrównać do 20 °C w odpowiednio termostatowanym spektrofotometrze przez ~10 minut.
Uwaga: Wszystkie kuwety można inkubować w tym samym czasie, ale odczytywać tylko jedną kuwetę na raz.
3. Następnie dodaj:
4. Natychmiast wymieszać przez odwrócenie i rejestrować wzrost A420 przez 3 minuty. Uzyskać DA420/20 sekund, stosując maksymalną szybkość liniową lub interwał 0,5 minuty dla wszystkich testów i ślepej próby.
Kryteria dopuszczalności: Szybkość DA420/20 sekund musi mieścić się w zakresie 0,18-0,34. Stężenie enzymu może być modyfikowane w razie potrzeby.
Wyniki
Obliczenia
1.

Gdzie:
3 = objętość (w mililitrach) oznaczenia
df = współczynnik rozcieńczenia
12.0 = Współczynnik ekstynkcji 1 mg/ml purpurogaliny przy 420 nm (wyznaczony wewnętrznie)
0,1 = Objętość (w mililitrach) użytego enzymu
2.
2.
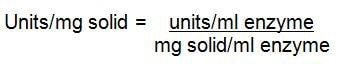
3.
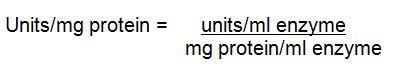
Referencje
04/17-1
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?