Testy aktywności enzymów
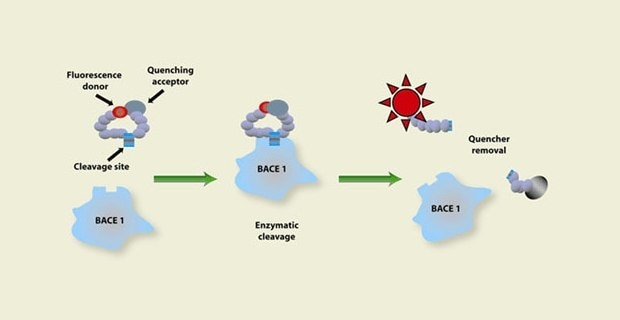
Rysunek 1. Przedstawienie procesu oznaczania aktywności enzymatycznej rozpoczynającego się od donora fluorescencji i akceptora wygaszania na substracie przechodzącym przez enzymatyczne rozszczepienie w celu usunięcia wygaszacza, pokazujące wzrost aktywności fluorescencyjnej, który sygnalizuje, że zachodzi aktywność enzymatyczna.
Analizy aktywności enzymatycznej są głównie wykonywane przez naukowców w celu identyfikacji obecności lub ilości określonego enzymu w organizmie, tkance lub próbce. Przykłady takich enzymów obejmują α-amylazę, katalazę, lakazę, peroksydazę, lizozym oraz enzymy reporterowe - fosfatazę alkaliczną i lucyferazę. Szeroko dostępne są różnorodne odczynniki i metodologie, które pozwalają na badanie specyficznych interakcji enzym-substrat. Wybór odpowiedniego rozwiązania zależy od czułości wymaganej przez badacza. Rozwiązania kolorymetryczne są przydatne do wykrywania, podczas gdy odczynniki oparte na fluorescencji lepiej nadają się do ilościowego określania aktywności enzymów.
Nagrodzone kategorie
Zasoby dotyczące dysocjacji tkanek i odłączania komórek, protokoły oraz kompleksowa oferta niezawodnych i szeroko scharakteryzowanych enzymów, w tym trypsyny, kolagenazy, papainy, nukleaz (DNazy i RNazy), hialuronidazy, elastazy i proteazy XIV.
Substraty i enzymy mają kluczowe znaczenie w badaniach z zakresu nauk przyrodniczych, zarówno jako narzędzia, jak i cele w systemach detekcji. Odkryj oparte na enzymach systemy wykrywania białek do testów ELISA, immunohistochemii, western blottingu i wielu innych, korzystając z naszego zróżnicowanego portfolio substratów i enzymów do wykrywania.
Enzymy do analizy leków, w tym β-glukuronidaza (beta-glukuronidaza) i sulfataza do metabolizmu leków i badań przesiewowych leków
Nasza oferta wysokiej jakości koenzymów niezawodnie ułatwia funkcjonowanie enzymów i katalizuje reakcje w zastosowaniach badawczych.
Określenie optymalnych warunków dla aktywności enzymatycznej
Chociaż w literaturze opisano wiele testów enzymatycznych, konieczne jest zmodyfikowanie tych procedur do unikalnych wymagań badanego enzymu. Specyficzna aktywność enzymu zależy od wielu czynników, w tym pH, temperatury, siły jonowej i stężenia wszystkich składników w teście. W warunkach takich jak pH, aktywność enzymu często przypomina krzywą dzwonową. Najwyższa aktywność przy określonym pH jest zgłaszana jako Vmax, z malejącą aktywnością obserwowaną na obu końcach krzywej. Niektóre enzymy mogą wymagać dodatkowego uwzględnienia związków, które nie są bezpośrednio zaangażowane w reakcję, takich jak jony metali, detergenty i cząsteczki hydrofobowe.
Określenie optymalnych warunków dla aktywności enzymatycznej
Chociaż w literaturze opisano wiele testów enzymatycznych, konieczne jest zmodyfikowanie tych procedur do unikalnych wymagań badanego enzymu. Specyficzna aktywność enzymu zależy od wielu czynników, w tym pH, temperatury, siły jonowej i stężenia wszystkich składników w teście. W warunkach takich jak pH, aktywność enzymu często przypomina krzywą dzwonową. Najwyższa aktywność przy określonym pH jest zgłaszana jako Vmax, z malejącą aktywnością obserwowaną na obu końcach krzywej. Niektóre enzymy mogą wymagać dodatkowego uwzględnienia związków, które nie są bezpośrednio zaangażowane w reakcję, takich jak jony metali, detergenty i cząsteczki hydrofobowe.
Składniki testu enzymatycznego
Dla wielu enzymów woda jest standardowym rozpuszczalnikiem, ponieważ jest to to samo środowisko wodne, które występuje w komórkach. Jednakże, rozpuszczalniki organiczne są stosowane w niektórych przypadkach, gdy enzymy lub składniki enzymów są nierozpuszczalne w wodzie. Dodatkowo, substraty i kofaktory, katalizatory reakcji enzymatycznych, są również krytycznymi składnikami w teście aktywności enzymatycznej. Substraty i kofaktory są często identyfikowane na podstawie ich funkcji w warunkach fizjologicznych. W związku z tym substraty i kofaktory wchodzą ze sobą w interakcje i mogą być wymagane przez wiele różnych enzymów. Bufory i jony są dodatkowymi krytycznymi elementami, które należy wziąć pod uwagę, ponieważ są one niezbędne do stabilizacji pH podczas testu i bezpośrednio wpływają na aktywność enzymu. Na przykład jedno- lub dwuwartościowe jony metali mogą być wymagane do katalitycznej aktywności kofaktorów w reakcji i są niezbędne do aktywności enzymu.
Performing an Enzyme Assay
Przygotowanie składników testu enzymatycznego jest praktycznym pierwszym krokiem. Ogólnie rzecz biorąc, korzystne jest przygotowanie dużej mieszaniny testowej, z wyłączeniem jednego składnika aktywującego, aby uniknąć błędu pipetowania, który jest nieodłączny podczas pipetowania małych objętości. Po przygotowaniu mieszaniny testowej badacze dodają do niej ostatni składnik aktywujący, aby zainicjować test aktywności. Wstępna obróbka enzymu polegająca na przechowywaniu go w niskich temperaturach i często z różnymi dodatkami chemicznymi lub białkowymi jest krytycznym czynnikiem zapewniającym stabilność enzymu i maksymalną aktywność przed rozpoczęciem testu. Po połączeniu materiałów reakcyjnych w naczyniu obserwacyjnym, wszystkie składniki należy szybko i dokładnie wymieszać, aby rozpocząć reakcję. Rejestracja danych powinna rozpocząć się natychmiast po wymieszaniu, a wykrywalny sygnał z testu powinien zostać wykreślony dla pełnego przebiegu czasowego reakcji.
Odwiedź naszą wyszukiwarkę dokumentów, aby znaleźć arkusze danych, certyfikaty i dokumentację techniczną.
Powiązane artykuły
- Explore compound library screening options with our Pharmacologically Active Compounds portfolio.
- Cholesterol esterification enhances transport efficiency in lipoproteins for increased blood stream transport.
- Complete List of Enzyme Commission Numbers for metabolics research.
- Lucyferaza Firefly jest czułym reporterem do badań genów ze względu na jej brak w komórkach lub tkankach ssaków.
- Odczynnik enzymatyczny Koenzym A (CoA, CoASH lub HSCoA) jest kluczowym kofaktorem w pierwszym etapie cyklu TCA, odpowiedzialnym za przeniesienie grupy acetylowej z utleniania pirogronianu do szczawiooctanu z wytworzeniem cytrynianu. Dostępny przez Sigma-Aldrich online.
- Zobacz wszystkie (36)
Powiązane protokoły
- Cathepsin B is a lysosomal cysteine proteinase with broad specificity. This protocol uses Nα–CBZ–Arg–Arg–7–amido–4–methylcoumarin as the substrate for fluorometric detection of Cathepsin B activity.
- Ta strona zawiera informacje o różnych testach pull-down do dalszej izolacji kompleksów wielobiałkowych w celu identyfikacji ich składników za pomocą produktów Cytiva.
- Postępuj zgodnie z naszą procedurą oznaczania aktywności alfa-amylazy. Ten test enzymatyczny a-amylazy prowadzi przez cały proces i niezbędne obliczenia.
- Katalaza katalizuje nadtlenek wodoru do wody i tlenu. Ten protokół wykorzystuje test spektrofotometryczny do oceny aktywności katalazy.
- To measure hyaluronidase activity, a turbidimetric determination assay is used at 600 nm. One unit of hyaluronidase activity will cause a change in absorbance of 0.330 per minute at pH 5.35 at 37 °C.
- Zobacz wszystkie (103)
Znajdź więcej artykułów i protokołów
Jak możemy pomóc
W przypadku jakichkolwiek pytań, prosimy o przesłanie prośby o wsparcie klienta
lub rozmowę z naszym zespołem obsługi klienta:
Email custserv@sial.com
lub zadzwoń +1 (800) 244-1173
Dodatkowe wsparcie
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Kalkulatory i aplikacje
Web Toolbox - narzędzia naukowe i zasoby dla chemii analitycznej, nauk przyrodniczych, syntezy chemicznej i materiałoznawstwa.
- Customer Support Request
Obsługa klienta, w tym pomoc przy zamówieniach, produktach, kontach i kwestiach technicznych związanych z witryną.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?



