PEPPSI™ katalizátorok áttekintése
PEPPSI™-IPr:
Bevezetés
A Yorki Egyetem professzora, Mike Organ, valamint munkatársai, Dr. Chris O'Brien és dr. Eric Kantchev, egy elegáns palládium N-heterociklikus karben (NHC) katalizátor rendszert fejlesztettek ki, amely egy egyszerű koncepció köré épül.1 PdCl2-t egy terjedelmes NHC ligandummal, 2,6-diizopropil-fenillimidazolium-kloriddal (IPr) és a stabilitás érdekében egy α-donáló 3-klórpiridin ligandummal reagáltatták. A címadó komplex, a PEPPSI™, a Ppiridin-Eerősített Pt jelenti./u>rekatalizátor Pelőállítás Sstabilizálása és Iindítása.
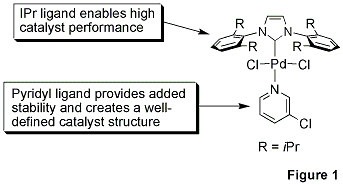
A 3-klórpiridil ligandum "eldobható" ligandumként működik, míg a terjedelmes IPr ligandum javítja a szubsztrát reduktív eliminációját, ami viszont növeli a TON-t (1. ábra).2 Az NHC ligandumok α-donáló ereje a hagyományos foszfinokhoz képest szorosabban is megköti a fémet, és így megakadályozza a fém disszociációját. Büszkék vagyunk arra, hogy az Organ kutatócsoporttal való együttműködésünk során a PEPPSI™ katalizátor grammos méretű mennyiségeit kínáljuk. A C-C és C-N kötésképző folyamatok hatékony közvetítése, a robusztus stabilitás és a versenyképes költségszerkezet vonzóvá teszi a széleskörű alkalmazásra a kutatásban és a finomkémiai színtéren.
A PEPPSI™-IPr katalizátorcsalád előnyei
- Rendkívül stabil a levegővel és nedvességgel szemben
- Kereskedelmi forgalomba hozatal kilogrammos méretben
- Az ismert Pd-katalizátorokhoz képest javított vagy hasonló aktivitás
- Nagy teljesítmény különböző reakcióparadigmákban
- Számos reakció szobahőmérsékleten zajlik
- Nincs szükség további ligandumokra ⇒ egykomponensű katalizátor
- Költség-kompetitív
Szabályozhatóság és kezelés
A hagyományos palládium-foszfin- és NHC-katalizátorokkal ellentétben a PEPPSI™ robusztus és inert atmoszférán kívül korlátlan ideig tárolható. A katalizátor a szokásos módszerek alkalmazásával mérlegelhető a mérőpadon, és még vízzel történő feldolgozásnak is alávethető 1H NMR segítségével megfigyelhető bomlás nélkül. Talán a leglenyűgözőbb, hogy a PEPPSI™-t 120°C-on dimetilszulfoxidban órákon keresztül melegítették 120°C-on bomlás és a katalizátor későbbi deaktiválódása nélkül. Ez a Pd(II)-komplex in situ aktívvá válik a Pd(0)-NHC aktív katalizátorrá történő redukció révén - így egy ligandummal stabilizált Pd(PPh3)4 helyettesítőnek tekinthető, mínusz a kezelési hiányosságok.
PEPPSI™-IPr reprezentatív alkalmazások
Negishi-kapcsolások
APEPPSI™-IPr (1) rendkívül hatékony és enyhe katalizátor alkil-alkil kötések kialakítására, amint azt a 2. ábra szemlélteti. Az 1 által közvetített sp3(RX)-sp3(RZnX) kapcsolások a funkcionalitások széles spektrumát foglalják magukban, mint például észterek, nitrilek, amidok és acetátok (2-5).2

A 7 vegyületben a terminális alkinil-TMS-csoport szobahőmérsékletű reakciókörülmények között teljesen stabil egy alkil-klorid keresztkapcsolásával szemben. Ezek az eredmények hitelt adnak a biológiailag aktív komponenseket tartalmazó szubsztrátok összekapcsolásának és ezt követően a természetes termék köztitermékek gyors szintézisének lehetőségére. A PEPPSI™ rendszer által támogatott alkil-bromidok, -kloridok és -tozilátok széles skálája kiterjeszti e reakcióparadigma általános használhatóságát (vegyületek 2 - 7). Hihetetlen, de az Organ kutatócsoport a reakciókörülmények megfontolt megválasztásával sikeresen elérte egy bromid klorid jelenlétében történő kapcsolását (2 vegyület 2). Megjegyezzük, hogy a PEPPSI™ által közvetített Negishi-kapcsolásokhoz vízmentes LiCl-oldatot adtunk THF-ben (667544), hogy megkönnyítsük ennek az adalékanyagnak a gyors alkalmazását.
Suzuki-kapcsolások
A PEPPSI™-IPr az elektronban gazdag (deaktivált) és elektronszegény (aktivált) szubsztrátok széles skálájával hatékonyan alkalmazható.3 E katalizátorrendszer magas aktivitása a Suzuki-kapcsolásban komoly érveket vet fel az ipari és egyetemi kutatólaboratóriumokban történő globális szintű alkalmazásra.

Minden Suzuki-reakciót tipikus laboratóriumi készítményekkel végeztünk, kesztyűs dobozban történő kezelés nélkül. A PEPPSI™-IPr előkatalizátort a levegőbe mértük, és in situ aktiváltuk inertgáztakaró alatt. Az Organ csoport a heteroatomos és elektronikusan változatos reakciópartnerek teljes kiértékelését végezte el. A különböző bórsavak reakciói zökkenőmentesen folytak reagens minőségű izopropanolban, és a kálium t-butoxidot találták optimális bázisnak a magas termékkonverzió biztosításához. Így a PEPPSI™-IPr széleskörű hasznosságát bizonyították szerves építőelemek összetett sorának nagy izolált hozamú előállításában (3. ábra).
Buchwald-Hartwig-aminálások
Az Organ csoport örömmel fedezte fel, hogy a PEPPSI™-IPr kiváló katalizátor az aril-kloridok és -brómiátok aminokkal történő palládium-katalizált keresztkapcsolásához.4

Az 4. ábrán látható eredmények azt mutatják, hogy e katalizátorrendszer alkalmazásával különböző aminok arilezése sikeresen és kiváló hozammal végezhető el. A morfolin, az arilaminok és még az adamantilamin is könnyedén aminálódnak, és így különféle aril- és biaril-aminok keletkeznek. Érdemes megjegyezni, hogy az enyhe reakciókörülmények (hőmérséklet és bázis) tolerálják az elektronban gazdag, elektronszegény és heteroaromás szubsztrátokat. Ez a megállapítás azt is mutatja, hogy a Pd-NHC-komplexek nem csak katalizátorként életképesek, hanem sok esetben óriási hatékonyságot és atomgazdaságosságot mutatnak az aromás C-N kötésképző folyamatokban.
Kumada-kapcsolások
Az arilhalogenidek Pd(0)-val történő oxidatív addíciójával és az azt követő Grignard-reagensekkel történő kapcsolással kapcsolatban számos tanulmányt végeztek, azonban ezen korábbi példák hiányosságai közé tartozik a nagy katalizátorterhelés, a magas hőmérséklet és az arilodid szubsztrátumok szükségessége a megfelelő konverziók eléréséhez.5 Az Organ csoport különböző aril-kloridok Kumada-kapcsolásairól számolt be Grignard-reagensekkel (5. ábra).6 Az aril-kloridok ezen szobahőmérsékletű oxidatív addíciói az eddigi legjobb eredményeknek felelnek meg. Az 1-2 mol%-os PEPPSI™-IPr-vel THF/DME-ben (1:1) szobahőmérsékleten végzett reakciók kiváló hozammal állították elő a megfelelő biarilszerveket.

Megjegyezzük továbbá, hogy mind az elektronban gazdag, mind az elektronban szegény Grignard-reagensek, valamint a sztérikusan akadályozott aril-kloridok is reakcióba léptek. Ez az enyhe Kumada-protokoll kiváló toleranciát mutat az éter-, TMS- és alkinil-funkciókkal szemben. A funkcionalizált 5-aril-szubsztituált indolok jó hozammal állíthatók elő.
Tandem-módszertan
Egy enyhe, új protokoll tovább bővíti a PEPPSI™-IPr katalizátor alkalmazási körét a C-N kötésképző folyamatokban. A jól ismert Fischer-féle indolszintézis kiegészítéseként,7 ahol egy N-acil-hidrazont szigmatrop átrendeződéssel indol-architektúrává alakítják, az Organ-csoport egy vinil-halogenidet reagáltatott különböző 2-bromanilinekkel PEPPSI™-IPr jelenlétében, hogy jó hozamokkal 2-helyettesített indolokat kapjanak (6. ábra).8

A PEPPSI™-IPr katalizátor rávilágít arra, hogy a saját katalizátorportfóliónk bővítésével, beleértve a Grubbs Nobel-díjas metatézis technológiát is, igyekszünk előmozdítani a tudományt ügyfeleink számára. A PEPPSI™-IPr-t nagyobb hatékonyság és kiváló funkciós csoport-tolerancia jellemzi, és az iparilag hasznos Suzuki, Negishi és Buchwald-Hartwig reakciókban megfelel vagy meghaladja a hagyományos foszfinrendszerek teljesítményét.
A PEPPSI™-SIPr egy új, korszerű katalizátor, amely sikeresen hajtja végre a keresztkapcsolási résreakciókat. Megjegyzendő, hogy ez a Pd-NHC katalizátor csak abban különbözik a PEPPSI™-IPr-től, hogy az NHC ligandum gerince telített, így további rugalmasságot és szubsztrátkontrollt biztosít a specifikus reakciókörülmények között. Az Organ csoport feltalált egy könnyen alkalmazható Kumada protokollt a PEPPSI™ katalizátorrendszert felhasználva, amely lehetővé teszi a gyógyszerszerű heterociklusok sokféle változatos skálájának gyors előállítását. A kihívást jelentő szubsztrátkombinációk könnyen átalakíthatók iparilag hasznos biaril és amin építőelemekké, amelyek alkalmasak a bonyolultabb architektúrák szintézisében való alkalmazásra (7. ábra).

A PEPPSI™-SIPr magas reaktivitása például elősegítette egy tetra-ortho-szubsztituált heterociklus szintézisét, először minden ismert katalitikus módszert alkalmazva (8. ábra). Ez a látványos eredmény, a megfigyelt reakciósebességgel kombinálva,9 azt jelzi, hogy a PEPPSI™-SIPr kissé felülmúlja a PEPPSI™-IPr-t a Kumada-reakcióban.

Ez a PEPPSI™ katalizátor kiegészítés eddig nem látott hatókör, reaktivitás és stabilitás előnyöket kínál a Kumada- és Buchwald-Hartwig-reakciókban. Megjegyzendő, hogy az előbbi esetben a heteroatom-tartalmú reakciópartnerek széles skáláját sikerült kiváló hozammal összekapcsolni. Nevezetesen, a 9. ábra -on látható naftilol-származék szintézisét 10 g-os méretekben 85%-os hozammal sikerült megvalósítani, ami tovább erősíti a rendszer ipari életképességét. Az Organ kutatócsoport arra is vállalkozott, hogy demonstrálja e rendszer erejét a nagy molekulatömegű fragmentumok összekapcsolásában, ami racionálisan alkalmazható lehet a késői fázisban lévő természetes termékszintéziseknél.

Következtetés
A PEPPSI™ katalizátorcsalád kiemeli, hogy a szabadalmaztatott katalizátorportfóliónk bővítésével, beleértve a Grubbs Nobel-díjas metatézis technológiát is, igyekszünk előmozdítani a tudományt ügyfeleink számára. A PEPPSI™-IPr-t nagyobb hatékonyság és kiváló funkciós csoport-tolerancia jellemzi, és az iparilag hasznos Suzuki, Negishi és Buchwald-Hartwig reakciókban eléri vagy meghaladja a hagyományos foszfinrendszerek teljesítményét.
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?