Az áramlási citometriás protokollok legfontosabb lépései
Az áramlási citometriás vizsgálat kulcsfontosságú lépéseinek apró részletei jelentős hatással lehetnek a kapott adatokra. A legtöbb áramlási citometriás protokollban négy lépés van:
Mintaelőkészítés
Áramlási citometriával értékelhető minden olyan sejtpopuláció, amely egyetlen sejtszuszpenzióvá alakítható. A következő három pontot fontos figyelembe venni:
- Az ex vivo sejtpopuláció elkészítéséhez a frissen boncolt szövetet gyakran kíméletesen homogenizálják mechanikus disszociációs módszerekkel, és a különböző sejttípusokat sűrűséggradiens centrifugálással választják szét, hogy eltávolítsák az intracelluláris mátrixanyagot, a törmeléket és az irreleváns sejtpopulációkat.
- Fontos megjegyezni, hogy a megtapadt sejteket a felhasználás előtt enzimatikus oldatok vagy kalcium kelátképző reagensek segítségével le kell választani a sejtkultúra edényeinek felületéről.
- A szuszpendált sejtkultúrákat csak meg kell számolni és meg kell vizsgálni az életképességet.
A sejtszám/titerek a szuszpenzióban lévő életképes sejtekre vonatkoznak, amelyek meghatározhatók egy automatizált sejtszámláló használatával és az elhalt sejtek/törmelék kizárására szolgáló kapuzás alkalmazásával. Alternatív megoldásként az életképességet az élő sejtek számának mikroszkópos megszámlálásával is meg lehet állapítani egy ismert térfogatban, például hemocitométer és Trypan-kék festék használatával, amelyet az élő sejtek ép membránja kizár, és csak a nem életképes halott sejtek veszik fel ezt a festéket.
Blokkolás
A primer antitest(ek) szuszpendált sejtekhez való nem specifikus kötődésének megakadályozására (a minta fajára specifikus) anti-Fc antitest hígítás alkalmazható. Ez megakadályozza az antitest Fc vagy állandó régiójának az Fc-receptorok általi kötődését, amelyek a legtöbb sejttípuson jelen vannak. Az Fc blokkot általában kis térfogatban adják a mosott sejtekhez. A festő antitest hígítását közvetlenül a blokkoló inkubáció végén adjuk hozzá, mosási lépés nélkül. Ez biztosítja, hogy a nem specifikus antitestkötés blokkolása végig fennmarad.
Antitest-inkubáció
Primer antitest-inkubáció
Más antitest-alapú alkalmazásokkal ellentétben, mint például az immunhisztokémia, az áramlási citometriában az antitest hígítása jellemzően nem a puffer térfogatához tartozó antitest tömegén, hanem a mintában lévő sejtek számához tartozó antitest tömegén alapul. Más alkalmazásokhoz hasonlóan az optimális koncentrációt empirikusan kell meghatározni. Az antitest hígítható áramlási citometriás vizsgálati pufferben. A kis térfogatokban történő festés javítja az antitest hozzáférését a szuszpenzióban lévő sejtekhez. Az inkubációs időszak végén a sejteket legalább háromszor kell festő- vagy vizsgálati pufferben mosni a nem kötött primer antitest eltávolítása érdekében.
Szekunder antitest inkubáció
Az indirekt kimutatási technika alkalmazása esetén az elsődleges inkubációt az egyes használt primer antitestek izotípusára specifikus másodlagos antitest megfelelő hígításával történő inkubáció követi. Többszínű detektálási kísérletekben minden egyes másodlagos ellenanyaghoz kellően különböző hullámhosszú vagy színű fluorofórokat kell választani, hogy lehetővé tegyék az egyes célpontok jelének megkülönböztetését. A másodlagos ellenanyaggal való inkubációt sötétben kell végezni a fényérzékeny fluorofórák védelme érdekében, és a mintákat - mint korábban - jégen kell tartani, és 4°C-on kell centrifugálni.
Fluorokrómok
Az áramlási citometriában használt számos antitest közvetlenül fluorokrómhoz konjugált; azonban számos nem jelölt elsődleges antitestet rutinszerűen használnak jelölt másodlagos antitestekkel kombinálva. Az áramlási citometriában leggyakrabban használt két fluorokróm a fluoreszcein-izotiocianát (FITC) és a fikoeritrin (PE). E színezékek két legfontosabb tulajdonsága, amelyek miatt előnyben részesítik őket, az, hogy mindkettő 488 nm-es lézerrel gerjesztett, és hogy emissziós spektrumuk eltérő, a FITC 530 nm-en (zöld), a PE pedig 570-575 nm-en (narancssárga). A fluorokróm-kémia és az áramlási citometria műszerezettségének fejlődése lehetővé tette a sejtek többszörös egyidejű jelölését és szortírozását az eredeti két színezéken túl.

1. ábra.FluoroFinder® Spectra Viewer kimenet a különböző fluorofórok gerjesztési és emissziós hullámhosszáról. Balról jobbra: mFluor 450, Alexa Fluor 488, PE, APC, iFluor 700 és iFluor 750.
Az adott áramlási citometriás kísérletben vizsgálható változók maximális száma a rendelkezésre álló fényforrások és detektorok számától függ. A több lézerrel rendelkező áramlási citométer lehetővé teszi a kutatók számára, hogy egyidejűleg olyan fluorofórokat használjanak, amelyek nem azonos gerjesztési spektrummal rendelkeznek, így bővítve az alkalmazható antitestek számát. Ezenkívül a több lézer több csatornával történő kombinálása még két különböző gerjesztésű, de hasonló emissziós spektrumú fluorofórt is megkülönböztethet, mivel a párhuzamos lézerelrendezésű eszközök képesek különálló emissziós jeleket gyűjteni egyetlen részecskéről, mivel azt az egyes lézerek egymás után gerjesztik.
Tippek a megfelelő fluorokrómok kiválasztásához:
- Válassza a fluorokrómok legvilágosabb készletét a műszerkonfigurációhoz.
- A műszerkonfigurációtól függően válasszon fluorokrómokat a spektrális átfedés minimalizálása érdekében.
- A legvilágosabb fluorokrómokat tartalékolja a gyengébb antitestekhez és fordítva.
- Kerülje el a fényes sejtpopulációkból a nagy érzékenységet igénylő detektorokba való átterjedést az ilyen populációk számára.
- Kerülje el a tandemfesték degradációját, és vegye figyelembe annak hatását az eredményekre.
A megfelelő fluorokrómok kiválasztásával kapcsolatos további információkért lásd a a megfelelő fluorokróm kiválasztása című útmutatónkat./a> az áramlási citometriás kísérlethez és az optimális panel felépítése a multicolor áramlási citometriás elemzéshez.
Fixálás és tárolás
Amint a felületi antigénfestés befejeződött, a sejteket foszfát-pufferelt sóoldatban lévő paraformaldehidben lehet fixálni, ahelyett, hogy a felvételhez reszuszpendálnánk. Ez akkor hasznos, ha a mintákat nem lehet a festés után azonnal felvenni, mivel lehetővé teszi a sejtek 4°C-on történő éjszakai tárolását. Ezt követően a fixálószert fel kell hígítani, és a sejteket legalább kétszer át kell mosni. Bár a festést követően azonnal ajánlott a felvételek készítése, a 4°C-on tárolt és fénytől védett, fixált sejtek a fixálás után akár 48 órával is felvehetők.
Intracelluláris célpontok: A sejtek permeabilizálása
Ha az érdeklődésre számot tartó fehérje(k) intracellulárisak, a sejtek rögzítése a felületi festést követően szükséges a szerkezeti szilárdság növelése érdekében, hogy a sejtek ellenálljanak a későbbi permeabilizálásnak, amely ahhoz szükséges, hogy az antitestek hozzáférjenek az intracelluláris antigénhez. A fixált és mosott sejteket permeabilizálni lehet egy megfelelő detergenssel foszfát-pufferelt sóoldatban legfeljebb 15 percig tartó, szobahőmérsékleten történő inkubálással, majd a detergensoldat hígításával és egyszeri mosással. Nem ionos detergensek, például szaponin használata ajánlott. A permeabilitást az antitesteket vagy sztreptavidint érintő minden lépés során fenn kell tartani, és ez úgy érhető el, hogy a festőpufferbe detergens kerül a későbbi festés során, egészen a fluorofór inkubációs lépésig bezárólag. Az intracelluláris antigén áramlási citometriával történő kimutatása egyébként a fentiekben ismertetett elveket és eljárásokat követi, és lehet közvetlen, közvetett vagy közvetlen/közvetett jelerősítéssel.
Adatgyűjtés
A legtöbb jelenlegi áramlási citométerhez tartozik a részecskejellemzők által generált jelek rögzítéséhez és átalakításához szükséges szoftver, amikor minden egyes sejt áthalad a detektoron. Ezek a szoftverek általában tartalmaznak olyan komponenseket, amelyek segítik a kísérlet szervezését, ami különösen fontos, ha több mintából származó különböző minták elemzését végezzük.
A többszínű kísérletek esetében kritikus fontosságú a kompenzációs paraméterek beállítása, felismerve a kísérletben használt különböző fluorofórok spektrumai közötti hullámhossz-átfedést. A kompenzációval kalibrálható az egyes fluorofór spektrumok spektruma, és lehetővé teszi a szomszédos csatornákból származó jelek kivonását a spektrális átfedés miatt.
Ha a kísérlete nem ad jó minőségű eredményeket, olvassa el Flow Cytometry Troubleshooting Guide című útmutatónkat a gyakori problémák megoldására vonatkozó tippekért.

2. ábra. A kétparaméteres áramlási citometriás ábrán látható, hogy a sejtek fényszórási jellemzőit hogyan használják fel az érdekes sejtpopulációk azonosítására, itt a méretük (előre szórás) és a sejten belüli komplexitásuk (oldalszórás) alapján. A felhasználó által meghatározott és alkalmazott kapukat vagy régiókat ezután az érdeklődésre számot tartó alpopulációk (itt a piros ovális jelöli a valószínűsíthetően életképes populációt) azonosítására használják a fókuszált elemzéshez.
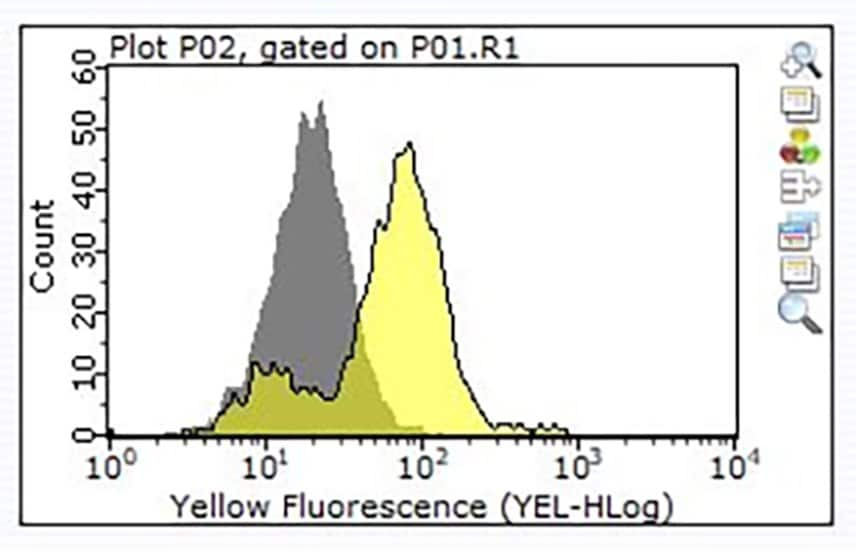
3. ábra. Egymillió Raji sejt festése 1 μg ZRB1564, Anti-CD24, 3N22 ZooMAb® nyúl monoklonális termékkel (sárga hisztogram) vagy ezzel egyenértékű mennyiségű nyúl IgG izotípusú kontrollal (szürke hisztogram), majd PE-konjugált szamár nyúl IgG ellenes másodlagos ellenanyaggal.
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?