SAB2702204
Monoclonal Anti-S Tag antibody produced in mouse
clone GT247, affinity isolated antibody
Szinonimák:
Anti-KETAAAKFERQHMDS tag, Anti-S peptide, Anti-S peptide epitope tag
About This Item
Javasolt termékek
biológiai forrás
mouse
Minőségi szint
konjugátum
unconjugated
antitest forma
affinity isolated antibody
antitest terméktípus
primary antibodies
klón
GT247, monoclonal
form
buffered aqueous solution
faj reaktivitás
human
koncentráció
1mg/mL
technika/technikák
immunoprecipitation (IP): suitable
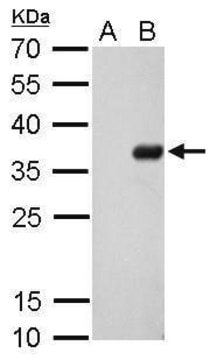
western blot: 1000-10000
izotípus
IgG2b
kiszállítva
wet ice
tárolási hőmérséklet
−20°C
célzott transzláció utáni módosítás
unmodified
Általános leírás
Immunogen
Alkalmazás
Tulajdonságok és előnyök
Egyéb megjegyzések
Fizikai forma
Jogi nyilatkozat
Nem találja a megfelelő terméket?
Próbálja ki a Termékválasztó eszköz. eszközt
Tárolási osztály kódja
12 - Non Combustible Liquids
WGK
nwg
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással