C4733
BID, Caspase-8-cleaved from mouse
≥95% (SDS-PAGE), recombinant, expressed in E. coli, buffered aqueous solution
Bejelentkezésa Szervezeti és Szerződéses árazás megtekintéséhez
Összes fotó(1)
About This Item
Javasolt termékek
rekombináns
expressed in E. coli
Minőségi szint
Teszt
≥95% (SDS-PAGE)
Forma
buffered aqueous solution
UniProt elérési szám
kiszállítva
dry ice
tárolási hőmérséklet
−20°C
Géninformáció
mouse ... Bid(12122)
Általános leírás
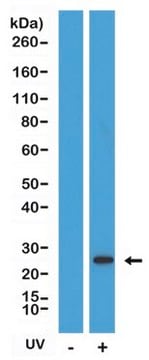
Mouse BID cleaved with caspase-8 generates the amino-terminal fragment (amino acids 1-59, 7 kDa) and the carboxy-terminal fragment (amino acids 60-195, 15 kDa). On size exclusion chromatography cleaved BID elutes at 27 kDa indicating that the fragments remain associated.
Biokémiai/fiziológiai hatások
Caspase-8-cleaved BID relocates from the cytosol to the outer mitochondrial membrane where its interaction with Bak alters mitochondrial membrane permeability.
Fizikai forma
0.2 μm filtered solution in 25 mM HEPES, pH 7.5, and 0.1 M KCl.
Analízis megjegyzés
Measured by its ability to induce cytochrome c release from isolated mouse liver mitochondria.
Tárolási osztály kódja
10 - Combustible liquids
WGK
nwg
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Válasszon a legfrissebb verziók közül:
Analitikai tanúsítványok (COA)
Lot/Batch Number
Nem találja a megfelelő verziót?
Ha egy adott verzióra van szüksége, a tétel- vagy cikkszám alapján rákereshet egy adott tanúsítványra.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
X Luo et al.
Cell, 94(4), 481-490 (1998-09-04)
We report here the purification of a cytosolic protein that induces cytochrome c release from mitochondria in response to caspase-8, the apical caspase activated by cell surface death receptors such as Fas and TNF. Peptide mass fingerprinting identified this protein
J Zha et al.
Science (New York, N.Y.), 290(5497), 1761-1765 (2000-12-02)
Many apoptotic molecules relocate subcellularly in cells undergoing apoptosis. The pro-apoptotic protein BID underwent posttranslational (rather than classic cotranslational) N-myristoylation when cleavage by caspase 8 caused exposure of a glycine residue. N-myristoylation enabled the targeting of a complex of p7
M C Wei et al.
Genes & development, 14(16), 2060-2071 (2000-08-19)
TNFR1/Fas engagement results in the cleavage of cytosolic BID to truncated tBID, which translocates to mitochondria. Immunodepletion and gene disruption indicate BID is required for cytochrome c release. Surprisingly, the three-dimensional structure of this BH3 domain-only molecule revealed two hydrophobic
H Li et al.
Cell, 94(4), 491-501 (1998-09-04)
We report here that BID, a BH3 domain-containing proapoptotic Bcl2 family member, is a specific proximal substrate of Casp8 in the Fas apoptotic signaling pathway. While full-length BID is localized in cytosol, truncated BID (tBID) translocates to mitochondria and thus
BCL-2 family members and the mitochondria in apoptosis.
A Gross et al.
Genes & development, 13(15), 1899-1911 (1999-08-13)
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással