A3832
Adrenomedullin Fragment 22-52 human
≥97% (HPLC)
Bejelentkezésa Szervezeti és Szerződéses árazás megtekintéséhez
Összes fotó(1)
About This Item
Tapasztalati képlet (Hill-képlet):
C159H252N46O48
CAS-szám:
Molekulatömeg:
3575.98
MDL-szám:
UNSPSC kód:
12352209
NACRES:
NA.26
Javasolt termékek
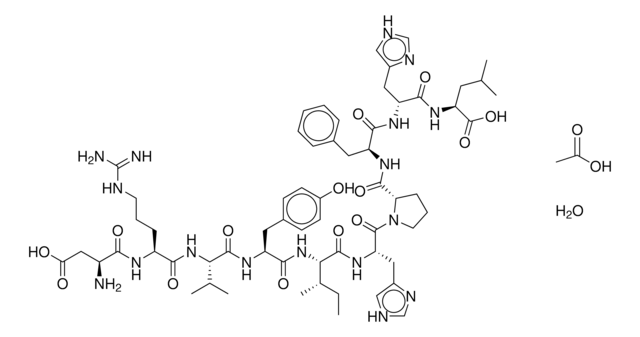
Amino Acid Sequence
Thr-Val-Gln-Lys-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys-Asp-Lys-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys-Ile-Ser-Pro-Gln-Gly-Tyr-NH2
Biokémiai/fiziológiai hatások
Adrenomedullin Fragment 22-52 [ADM22-52] is used as an adrenomedullin (ADM) receptor antagonist to study the functions and mechanism of action of ADM signaling. ADM(22-52) is used to differentiate adrenomedullin binding sites in various cells and tissues.
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Egyéni védőeszköz
Eyeshields, Gloves, type N95 (US)
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Jing Hui Yang et al.
Regulatory peptides, 158(1-3), 19-25 (2009-06-16)
Intermedin (IMD) is a novel peptide related to calcitonin gene-related peptide (CGRP) and adrenomedullin (ADM). Proteolytic processing of a larger precursor of IMD yields a biologically active C-terminal fragment IMD(1-53). We aimed to observe the cardioprotective antifibrotic effects of IMD(1-53)
Christian Juaneda et al.
European journal of pharmacology, 474(2-3), 165-174 (2003-08-19)
The existence of specific adrenomedullin receptor binding sites was investigated using the agonist peptide fragment [125I]human adrenomedullin-(13-52) in rat brain, lung and vas deferens homogenates. Saturation-binding experiments suggest that [125I]human adrenomedullin-(13-52) binds to an apparent single population of sites with
Takahisa Ishikawa et al.
Oncogene, 22(8), 1238-1242 (2003-02-28)
Since it is reported that adrenomedullin (AM) upregulated by hypoxia inhibits hypoxic cell death, we examined the effects of AM antagonist (AM C-terminal fragment; AM(22-52)) on the growth of pancreatic cancer cells. We, for the first time, demonstrated that AM
Agnieszka Ziolkowska et al.
International journal of molecular medicine, 11(5), 613-615 (2003-04-10)
Adrenomedullin (ADM) and its receptors are expressed in the adrenal cortex, where ADM is currently known to inhibit agonist-stimulated aldosterone secretion from zona glomerulosa (ZG), without affecting either basal aldosterone release or the secretory activity of zona fasciculata-reticularis (ZF/R) cells.
Benjamin Uzan et al.
Journal of cellular physiology, 215(1), 122-128 (2007-10-18)
Adrenomedullin (ADM) has been shown to mediate multifunctional responses in cell culture and animal system such as regulation of growth and apoptosis. ADM stimulates the proliferation of osteoblasts in vitro and promotes bone growth in vivo. The ability of ADM
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással