400012
Caspase-1 Inhibitor II
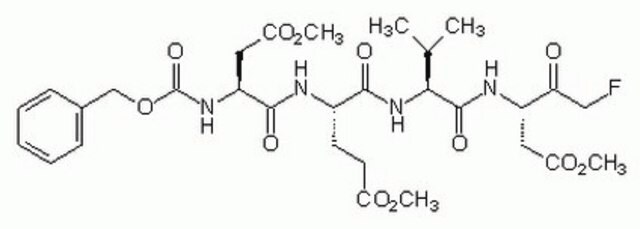
The Caspase-1 Inhibitor II, also referenced under CAS 178603-78-6, controls the biological activity of Caspase-1. This small molecule/inhibitor is primarily used for Cancer applications.
Szinonimák:
Caspase-1 Inhibitor II, IL-1β Converting Enzyme (ICE) Inhibitor II, Ac-YVAD-CMK
About This Item
Javasolt termékek
Minőségi szint
Teszt
≥95% (HPLC)
form
solid
gyártó/kereskedő neve
Calbiochem®
tárolási körülmény
OK to freeze
desiccated
szín
white
oldhatóság
DMSO: 5 mg/mL
kiszállítva
ambient
tárolási hőmérséklet
−20°C
InChI
1S/C24H33ClN4O8/c1-12(2)21(24(37)26-13(3)22(35)28-17(10-20(33)34)19(32)11-25)29-23(36)18(27-14(4)30)9-15-5-7-16(31)8-6-15/h5-8,12-13,17-18,21,31H,9-11H2,1-4H3,(H,26,37)(H,27,30)(H,28,35)(H,29,36)(H,33,34)/t13-,17-,18-,21-/m0/s1
Nemzetközi kémiai azonosító kulcs
UOUBHJRCKHLGFB-DGJUNBOTSA-N
Általános leírás
Biokémiai/fiziológiai hatások
caspase-1
Figyelmeztetés
Szekvencia
Feloldás
Egyéb megjegyzések
Garcia-Calvo, M., et al. 1998. J. Biol. Chem. 273, 32608.
Hilbi, H., et al. 1998. J. Biol. Chem. 273, 32895.
Thornberry, N.A., and Lazebnik, Y. 1998. Science 281, 1312.
Schlegel, J., et al. 1996. J. Biol. Chem.271, 1841.
Enari, M., et al. 1995. Nature375, 78.
Walker, N.P.C., et al. 1994. Cell78, 343.
Thornberry, N., et al. 1992. Nature356, 768.
Jogi információk
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással