09-814
Anti-dimethyl-Arginine Antibody, asymmetric (ASYM25)
serum, from rabbit
Szinonimák:
dimethyl-arginine, asymmetric
About This Item
Javasolt termékek
biológiai forrás
rabbit
Minőségi szint
antitest forma
serum
antitest terméktípus
primary antibodies
klón
polyclonal
faj reaktivitás
mouse
faj reaktivitás (homológia által előrejelzett)
rat (based on 100% sequence homology), human (based on 100% sequence homology)
technika/technikák
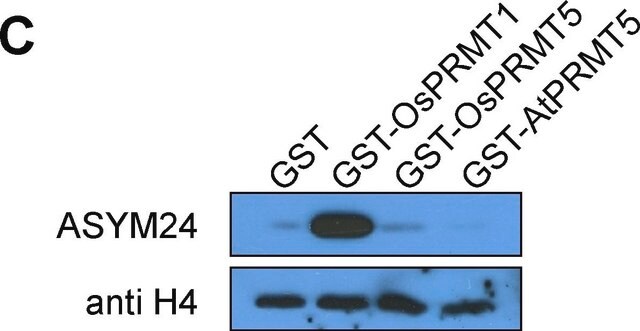
western blot: suitable
kiszállítva
wet ice
célzott transzláció utáni módosítás
unmodified
Általános leírás
Egyediség
Immunogen
Alkalmazás
Minőség
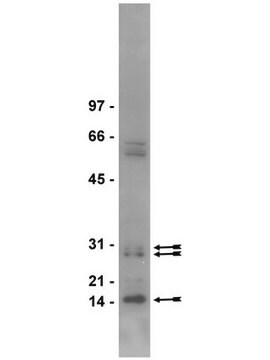
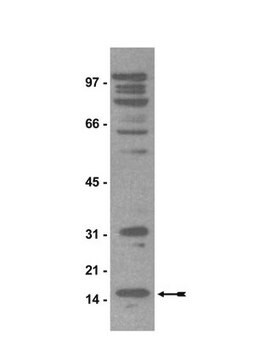
Western Blot Analysis: 1:1,000 dilution of this antibody detected dimethyl-Arginine on 10 µg of PRMT1 treated and untreated MEF cell lysates.
Cél megnevezése
Analízis megjegyzés
PRMT1 treated and untreated MEF cell lysates
Nem találja a megfelelő terméket?
Próbálja ki a Termékválasztó eszköz. eszközt
Tárolási osztály kódja
10 - Combustible liquids
WGK
WGK 1
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással