制定 PCR 或 RT-PCR 疑難排解方案
錯誤和/或問題的潛在來源 操作錯誤
操作錯誤有許多可能性。這些錯誤的源頭往往無法識別。任何故障排除程序的第一步都是檢查方案並重複實驗。檢查協議(參考 Appendix A, Protocols, of this guide)和請一位有經驗的分子生物學家審查實驗計劃是很重要的。有一位博士後研究員在進行了幾次失敗的 PCR 後,才意識到 dNTPs 在PCR 母液 提醒我們,即使是最優秀的工作過度的科學家,也很容易發生簡單的錯誤。
主混合物
反应组分的主混合物混合错误或问题可能是所有样本和阳性对照扩增灾难性失败的根源。重複實驗前,請檢查所有組份及其濃度。
在轉換混合母液產品時,必須認識到某些檢測對緩衝液成分/退火溫度 (Ta) /引物濃度組合特別敏感。改變其中任何一個組合都可能導致不同的性能。因此,在進行重大變更之前,請在選定的主混合物和所有需要的儀器上驗證所有的檢測。此外,檢視每種混合母液所提供的說明也很重要,因為這些說明指定了針對特定酵素、熱啟動機制和緩衝液成分最佳化的建議條件。
| 問題 | JumpStart™ Taq ReadyMix™ 的效果不如其他供應商的 同類產品 |
|---|---|
| |
| 診斷測試 |
|
| 溶液 |
|
| Problem | PCR ReadyMix 適用於 PCR 但不適用於 qPCR,但 |
|---|---|
| 可能的原因 |
|
| 診斷測試 |
|
| 解決方案 |
|
良好的實驗室慣例是確保為所有要一起進行實驗的樣品準備足夠的反應母液。確保所有成分都已仔細解凍和充分混合,並確保在等分到樣品之前,實驗混合母液已非常充分地混合。這與某些 2× 緩衝液(例如 KiCqStart® 比一般 PCR 緩衝液更黏稠)特別相關。
寡核苷酸優化
如果寡聚物的序列不正確或設計不佳、以次優濃度運行、次優 Ta 或未充分標記或淬滅(用於探針),則可能導致問題。在寡核苷酸次佳條件下執行的檢測,或使用設計不良的寡核苷酸,可能會產生一些數據,但這可能無法反映真正的生物學考慮。在收到凍乾的寡核苷酸時,關鍵是要:
- 驗證序列
- 確保所有 DNA 在使用前都已重新懸浮
將寡核苷酸加熱至 90 °C 5 分鐘,然後充分混和,以重懸寡核苷酸。重複的凍融週期也會影響 oligo 的性能,因此所有濃度的 oligo(通常為 100 μM)都應該等分並儲存於 -20 °C,或長期儲存於 -80 °C。
在疑難排解階段,關鍵是要確認是否訂購了正確的序列,方法是回到目標序列並確認 oligo 序列確實存在。聯絡寡核苷酸供應商,確保寡核苷酸品質正確。測量寡聚物的工作濃度,並目視檢查螢光分子,確認這些分子已被標記。在 SYBR® Green I qPCR 混合液中測試探針檢測的引物,以驗證擴增效果。考慮優化引物濃度或 Ta (見 Assay Optimization and Validation)。首次使用探針時,盡可能收集多個潛在波長的螢光數據,以便觀察通道間任何潛在的信號洩漏,並檢測標記中的錯誤。
PCR優化不足
在 Assay Optimization and Validation。當一項檢驗失敗或表現未達最佳,但在設計或操作程序上沒有任何錯誤時,可能會受益於實驗條件的最佳化。排除故障時,在 100 nM、500 nM 和 900 nM 終極濃度和/或 Ta 55 °C 至 70 °C 之間(使用溫度梯度)測試引物,以確定檢測是否會隨著進一步優化而改善。
RT-PCR 和 qPCR 分析設計
。Assay design was described in PCR/qPCR/dPCR 分析設計。排除化驗故障時,請確保設計已經過驗證。確認 PCR/qPCR 引物和擴增子位置與 RT 引物協議一致。例如,確保應用於寡聚-dT 引物後製備的 cDNA 的檢測位置朝向轉錄本的 3'。確保序列資訊可靠,並已考慮適當的剪接變異和 SNP。
| Problem | 檢驗不靈敏,擴增圖看起來 異常(圖 11.1) |
|---|---|
| 可能的原因 |
|
| 診斷測試 |
|
| 解決方案 |
|

圖 11.1A.該檢測具有異常的擴增圖譜,基線有明顯的漂移。

圖 11.1B.包含在檢測中的探針序列被輸入到 mfold 折疊預測軟體中。很明顯,探針可以在溶液中採用穩定的折疊結構,這很可能會導致觀察到的問題。
RNA 或 DNA 模板質量
模板質量對檢測性能的影響已在&.nbsp;樣本純化與品質評估。模板品質包含數量、完整性及抑制劑的存在等考量。確保 RNA 品質與最適當的 RT 引物協議相匹配(請參閱 Reverse Transcription),並盡可能使用品質最好的模板,這一點至關重要。同樣地,加入 RT 反應的 RNA 數量也必須在規範的範圍內,而且在許多情況下,所有反應的 RNA 數量都應該相同。ReadyScript® 是此準則的一個顯著例外,因為採用此試劑和方案可產生與輸入 RNA 量成正比的線性 cDNA 濃度。當發現一個樣品的 Cq 高於預期時, 執行 SPUD 分析或將樣品以 1:5 或 1:10 稀釋系列稀釋,並重複分析(圖 11.2)以識別含有抑制劑的樣品。
| Problem | The Cq data for dilutions of the standard curve are irregularly spaced (Figure 11.2) |
|---|---|
| 可能原因 |
|
| 诊断测试 |
|
| 解 |
|


圖 11.2.擴增 10 倍序列稀釋的 DNA 樣板。複製是精確的,但 ΔCq 並不一致,隨稀釋度增加而降低。資料也顯示無模板對照 (NTC) 有陽性信號,顯示污染或引物二聚體的形成,稀釋至小於 105 copies 時的資料與 NTC 完全相同。
| 稀釋 | ΔCq |
|---|---|
| 107 → 106 | 5.4 |
| 106 → 105 | 5.0 |
| 105 → 104 | 3.6 |
模板數量也是一個重要的考慮因素。在 PCR 中加入過多或過少的模板都會導致反應失敗,qPCR 的擴增圖表也會出現異常。 圖 11.3A Show a reaction containing a 10-fold serial dilution of artificial oligo template.Figure 11.3A 顯示的是含有 10 倍序列稀釋的人工寡核苷酸模板的反應,較低的稀釋度對於反應效率或儀器有效處理基線數據(圖 11.3B )來說過於濃縮,導致擴增圖表異常和數據不可靠。

圖 11.3.A)使用特定引物和 FAM 標記探針擴增 10 倍序列稀釋的人工模板。濃縮樣本的 Cq 非常低,擴增圖的間距不規律,而且不正常。B) 顯示這些擴增圖形的原始資料。含有最高濃度目標物的反應,其背景螢光也明顯較高,且透過反應的螢光產量極少。
測試 PCR 程式
PCR 循環條件必須同時適合實驗和試劑 (例如、 見 Master Mix)。未經驗證就接受預設的儀器設定是不可取的。
Thermal Cycler 故障
儀器故障的發生可能很隱蔽,因此難以診斷。為了避免昂貴的維修費用,請確保儀器的所有操作人員都經過全面訓練,並接受初步監督。有些儀器故障會造成災難性故障,導致沒有擴增或螢光數據,有些則會扭曲數據或以非均一方式處理樣本,造成相同生物樣本間的人為差異。使用對照檢測的對照樣本對於故障排除是非常寶貴的。當懷疑儀器故障時,應在所有孔中執行可靠的最佳化驗。這種均勻性檢查將揭示特定於儀器區域的問題,以及獨立的檢測和儀器問題。
PCR 疑難排解範例展示診斷工具的使用
在執行規劃良好的 PCR 之後,有幾個診斷工具可用於疑難排解:
- 對照樣品和檢測
- 端點凝膠/SYBR Green I 染料試劑
- 擴增圖表擴增圖(檢查複製品和擴增圖輪廓)
- 標準曲線(梯度和R2)/稀釋系列
- 熔解/解離圖(SYBR Green I 染料、Molecular Beacons、Scorpions® 探針)
- 原始數據/多重數據
原始資料/多元件檢視
控制樣品/實驗
強烈建議使用控制樣品。如果沒有來自適當的控制套件的資訊,幾乎不可能對失敗的檢測進行故障排除。
| Control | 範例材料 | 預期結果 | 陽性結果的可能原因 陽性結果的可能原因 | 陰性結果的可能原因 |
|---|---|---|---|---|
| 已知含有檢測 序列的樣品,例如 | 測試失敗。 | |||
| 檢測失敗。 | 检测失败。任何來自其他樣本的陽性數據都是不可靠的。 | |||
| 已知不包含檢測序列的樣本,例如不表達/不包含目標的 RNA/gDNA。 | 檢測非特定或在 PCR 製備過程中對照品受到污染 | 污染 陰性檢測對照(無模板對照 NTC) | 引物自我二聚導致引物二聚產物或在 PCR 製備過程中對照受到污染。 | 正確 |
| RT 特有的控制 | 範例材料 | 預期結果 | 可能的反應 | 陽性結果的可能原因 | 陰性結果的可能原因 |
|---|---|---|---|---|---|
| 除 RT 酵素外,RNA 樣本和 RT 反應的所有成份。這應該在所有樣品上執行,以驗證它們不包含在 PCR 條件下擴增而不需要 RT 的序列,例如 gDNA 污染 | 樣品包含 gDNA。反應在設定過程中受到污染。引物形成引物二聚體產物。 結合 NTC 分析 | 正確 |
| 特定基因分型 | 範例材料 | 預期結果 < | 分析特定陽性目標。 | 使用 WT 分析檢測野生型 (WT) 模板,使用突變型分析檢測突變型目標。 |
| |
|---|---|---|---|---|---|---|
| Assay specific negati\le target | WT 模板被突变体检测法检测到,突变体靶标被 WT 检测法检测到。 | 陰性(或與陽性對照相對較高的 Cg)。 |
| 雜合子模板或 1:用 WT 分析法和突變體分析法檢測到的各個同型雜合子的 1: 1 混合。 | 兩種檢測均呈陽性。 |
|
| Problem | 陽性對照可以擴增,但已知含有目標物質的樣本卻沒有擴增 結果(圖 11.4A) |
|---|---|
| 可能原因 |
|
| 診斷測試 |
|
| 溶液 |
|

圖 11.4.A)未稀釋的模板無法擴增,而稀釋的模板則可提高擴增效率。B) 在 qPCR 混合液中加入 0.3% BSA 可支持未稀釋模板的擴增。
對完全失敗的檢測進行調查可能很困難,因為幾乎沒有可進行故障排除的資訊。由於許多檢測失敗都是由某些災難性錯誤造成的,因此首先應檢查確認實驗設定,然後重複 PCR。如果失敗,故障排除過程取決於實驗每個組成部分的相關資訊(圖 11-5)。

圖 11.5.PCR 的基本故障排除流程。
當qPCR實驗完全失敗時,第一步是檢查檢測設計、寡核苷酸序列和寡核苷酸製造商提供的QC數據。 Figure 11.6A shows the raw data plot for two assay containing either a 6-FAM™ or a HEX™ (VIC®) labeled probe.雖然兩種檢測都顯示出擴增,但 HEX 訊號約為 FAM 訊號的一半。由於這是一種本質上較弱的染料,因此這是正常的觀察結果。琼脂糖凝膠分析(圖 11.6B)顯示兩種反應產生的產物濃度相似,支持 qPCR Cq 值相似的觀察。

圖 11.6.A)包含 FAM 和 HEX 標籤探針的雙重實驗的原始數據圖。FAM 探針自然產生較高的螢光。B) 琼脂糖凝膠顯示每個反應都產生了等量的產物,證實了 qPCR Cq 觀察結果。
檢查原始數據是一種有用的檢查方法,可以驗證探針是否被正確標記,以及是否被添加到反應中。 圖 11.7 顯示了三重實驗中三個目標擴增的原始數據。每個目標的特異探針都標有 FAM、HEX 和 TAMRA。HEX 和 TAMRA 探針顯示出低背景和有效的擴增,然而 FAM 訊號在整個實驗中持續偏高,沒有證據顯示有擴增。這與反應中探針濃度過高或探針出現故障導致信號沒有初始淬滅一致。在這種情況下,應驗證探針濃度和檢測設計,確保探針具有相容的標籤和淬滅劑,必要時測試新的探針。
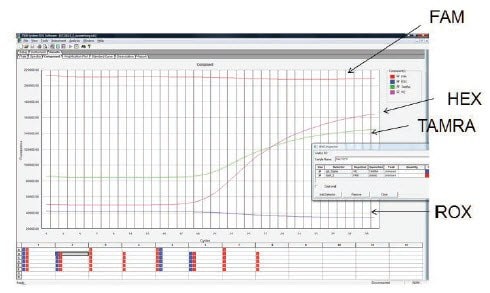
圖 11.7.使用標有 FAM、HEX 和 TAMRA 的探針進行三重反應以檢測三個目標。HEX 和 TAMRA 探針從目標物產生擴增,但 FAM 探針沒有顯示任何擴增。檢查原始資料後發現,背景螢光特別高,而且在整個反應過程中沒有觀察到任何差異。這與反應中探針濃度過高或淬火不足的故障探針相符。
如果原始實驗依賴探針檢測,則應使用 SYBR Green I 試劑重複檢測,包括陽性和陰性對照(但不包括珍貴樣品)。另外,也可以在溴化乙锭染色的琼脂糖凝胶上检查失败反应的产物。採用 SYBR Green I 方法重複實驗較為可取,因為它可避免污染的風險,並提供重複實驗來驗證最初的失敗。如果 SYBR Green I 實驗提供了數據,那麼最初的探針失效有可能是由於技術錯誤或探針故障。為了區分是實驗錯誤還是探針故障,請重複探針實驗;如果反應再次失敗,請更換探針。此方法可用於調查產生不良資料的反應。在 圖 11.8所示的例子中,探針反應未達最佳,與使用 SYBR Green I 執行的反應比較,可以看出探針信號無法反映實驗。在這種情況下,應驗證分析設計,並測試新的探針。

圖 11.8.運行含有 qPCR 探針或 SYBR Green I 染料(如所示)的相同反應。SYBR Green I 反應的靈敏度高出約 11 個週期,而且產生的終點螢光也高得多。這顯示探針有故障或探針設計有問題(數據由英國 Stephen Bustin 教授提供)。
验证探针标记
原始数据或多组分图是一个有用的诊断工具,用于调查反应中是否包含了适当浓度的探针,以及探针是否被充分标记和淬灭。 圖 11.9 顯示了包含三個探針的反應的多分量圖。前兩個探針產生放大圖,背景螢光明顯。第三個探針沒有數據,檢查原始數據後發現,背景螢光等於不含任何探針的水空白對照。因此,此數據是反應中沒有螢光的結果。這可能是由於設置過程中出現錯誤,未包含探針或探針未被標記所致。

圖 11.9.在同一樣本中檢測到三個基因。其中兩個反應有擴增結果(1 和 2),但第 3 個反應呈陰性。多組分檢視顯示,第 3 個反應的背景螢光與水對照相等,表示沒有信號。
可以使用 DNase I 消解來進一步檢查探針標記。這必須非常謹慎地進行,以確保探針和引物庫存不被酶污染,否則會導致災難性的結果。可以實時進行(圖 11.10B),以便測量與時間相關的螢光產量,或者,初始和終點(10 分鐘後)讀數提供足夠的資訊。進行此測試時,重要的是將數據與功能良好且具有相同螢光標籤和淬火劑的探針進行比較(圖 11.10B)。

圖 11.10.A)使用不同的探針檢測兩種模板,兩種探針都是 FAM 標記。使用其中一種探針進行檢測會產生高螢光信號,而使用第二種探針進行檢測則會產生較弱的螢光信號。B) 在有或沒有 DNase I 酶的情況下,將一個對照探針和一個測試探針(300 nM)在 37 °C、DNase I 緩衝液中的實時儀器中孵育。探針 1 的螢光釋放量約為探針 2 的兩倍,證明探針 2 的標記不足。
| 測試樣本與陽性對照的螢光都很低或沒有螢光。 凝膠上可見正確的 PCR 產物,並驗證設計 | |||
|---|---|---|---|
| SYBR Green Dye-Based Detection | 探針檢測 | ||
| Possible Cause | 不良的SYBR Green I結合染料。 |
|
|
| Diagnostic Test |
|
|
|
| Solutions | 購買新的 SYBR Green I 結合染料或含有 SYBR Green 結合染料的新 qPCR 混合物。 |
| 購買新的探針。 |
扩增图
扩增图的结构和技术重复的可重复性提供了有关 qPCR 检测质量的大量信息,也可能提供了一切不尽如人意的第一个警告信号。圖 11.11A 中的擴增圖並不典型,而且非常嘈雜,難以準確詮釋。進一步檢查 dR 螢光值發現,終點螢光產量只有 400 個單位,這表明反應是不充分的,但擴增圖表是由儀器軟體產生並自動調整了比例。同樣地, 圖 11.11B 中的數據在剖面開始時有明顯的狐尾(曲線遞減),在基線部分之後再次增加。在兩個反應中,狐尾的外觀是一致的,但其中一個反應的終點更低(圖 11.11C),導致放大的相對狐尾。
圖 11.11.A)由於儀器軟體對低螢光的不良資料進行自動縮放而產生雜訊的擴增圖表。 B) 產生低終點 dR 的反應有明顯的初始狐尾。)
類似地, 圖 11.12A 中的擴增圖表明顯不正常,不能使用。dR 低於零的擴大圖(圖 11.12A)是應用了不適當基線設定的典型跡象。檢查此反應的原始數據(圖 11.12B)顯示,實際的擴增圖表具有正常的輪廓,證實分析的數據是由於儀器軟體問題造成的。可以從原始數據推斷出適當的基線,並在軟體中應用。在這種情況下,循環 6 至 16 代表反應的初始線性、基線階段,應用時會產生正常的擴增圖形(圖 11.12C)。

圖 11.12.A)放大圖顯然不正常,有一段剖面浸入基線以下。B) 檢查原始數據圖顯示反應數據符合預期。C) 根據適當的週期設定儀器基線,使分析擴增圖的資料恢復正常剖面。

圖 11.13.cDNA 樣本經過 10 倍序列稀釋,每個稀釋度使用重複 qPCR 檢測特異性模板。重複結果不佳,表示移液或檢測最佳化有問題。
| Problem | 螢光圖突然尖峰向上 (圖 11.14)。 |
|---|---|
| 可能的原因 | 參考染料不良或儀器錯誤(例如、 |
| 可能的原因 | 參考染料不良或儀器錯誤(例如:運行期間門打開)。 |
| 診斷測試 |
|
| 解決方案 |
|

圖 11.14.在標準的 qPCR 過程中,數據會突然以非典型的輪廓向上飆升。
| Problem | Declining or hooked fluorescence plots (Figure 11.15) |
|---|---|
| 可能的原因 | 當 PCR 產物累積時,輔助鏈會與引物和/或探針競爭 退火至模板。 |
| 診斷測試 | 見圖 11.15。 |
| 解決方案 | 如果Cq 沒有受到影響,則不予理會。 |

圖 11.15.對於下降或鉤狀的螢光圖,可能的原因是由於互補鏈與引物和/或探針競爭退火至模板。只要不影響 Ct 即可忽略。
解离/熔解曲線
解離或熔融曲線分析是在 qPCR 之後運行的,是一種分析工具,可與 DNA 結合染料(如 SYBR Green I)或非降解探針(如 Molecular Beacons 或 Scorpions® 探針)配合使用,以驗證是否已擴增了單一產物。PCR 擴增之後,將產生的擴增片段在升高的溫度下孵育,當 DNA 在雙鏈與單鏈狀態之間轉換時,可偵測到螢光信號的變化。當反應包含單一的擴增子時,此擴增子會均勻地熔化,dF/dT(螢光相對於溫度的變化率)的圖表會顯示出單一的峰值。 Figure 11.16A shows the post qPCR melt profile for a series of experimental test samples, the positive control and the no template control.測試樣本的熔融曲線圖與陽性對照相同,且每個樣本的 dF/dT 都顯示單一峰值。無模板對照的熔融剖面則較寬,且 Tm 較低。這些觀察結果都與陰性對照中引物二聚體的明顯存在一致。使用溴化乙锭染色的琼脂糖凝胶(图 11.16B)证实了这一点,该凝胶还显示,当模板存在于低浓度时,引物二聚体变得明显。這會導致在低目標濃度的樣品中檢測時,對目標值的估計過高。因此,應該優化或重新設計檢測方法。相反, 圖 11.16C 顯示無模板對照中產品的熔融曲線與陽性對照和測試樣本的熔融曲線相同。這清楚顯示在實驗設置過程中,無模板對照被模板污染了。最後一個例子展示了從存在於 cDNA 樣品中的 gDNA 擴增目標的識別(圖 11.16D)。來自 gDNA 的擴增片段較長,因此比來自 cDNA 的擴增片段有
較高的 Tm

圖 11.16A.對陽性對照、測試反應和 NTC 進行擴增,然後進行 PCR 後熔融分析。NTC 中有明顯的產物在較低的溫度下熔解,且熔解峰較寬,這與引物二聚體的形成相符。

圖 11.16B.引物二聚體在這些樣本(以及其他樣本)的凝膠解析中很明顯,引物二聚體的形成與輸入模板濃度成反比。

圖 11.16C.應用熔融曲線分析來識別 NTC 中反應污染的範例。
圖 11.16D.識別 gDNA PCR 產生的較大擴增片段。
| Problem | 熔融剖面資料中的多個Tm peaks in melt profile data | ||
|---|---|---|---|
| 凝膠上的單一產品 (圖 11.17) | 凝膠上有多個產品 | ||
| 可能的原因 | 局部的 AT 或 GC 豐富區域PCR產物中的AT或GC豐富的區域 | 局部的AT或GC豐富的區域 | 引物不具特異性,並 產生多個產物。
|
| 診斷測試 | 檢查擴增序列是否有 富含AT或GC的區域或重複。 | 將引物序列與來源生物的 序列進行BLAST,以 驗證單一目標物。 | |
| 解決方案 | 如果凝膠 分析顯示所有的產物 都是特異性的,就沒有問題。繼續使用引物。 |
| |

圖 11.17.A)A 熔融曲线和 B) SYBR green I 反应的琼脂糖凝胶分析。雖然熔融剖面顯示不同 Tm 的產物,但凝膠圖像顯示存在單一的擴增片段。這表示擴增子序列包含富含 AT 或 GC 的區域或重複元件,造成不規則的熔解。
模板的序列稀釋/標準曲線
無論實驗設計是否包括最終定量的標準曲線要求,檢測合適模板的序列稀釋是檢測驗證和故障排除的有力方法。檢測系列稀釋液可以定義檢測的實驗線性動態範圍。 圖 11.18A Show a standard curve with low concentration data points that do not fit the linear profile. 圖 11.18A 顯示了一條標準曲線,其中的低濃度數據點不符合線性曲線。出現這種數據模式的最通常原因是引物二聚體已在低濃度樣品中形成(如 圖 11.18B所示)。這是根據 圖 11.2中的數據產生的標準曲線。 圖 11.18C Figure 11.18C 顯示了高濃度樣品跌出線性範圍的標準曲線。最常見的原因是反應的模板抑制或基線設定不適當。

圖 11.18.A) 與低濃度目標物相關的數據點不在標準曲線上。B) 如圖所示,這是典型的引物二聚體反應。在這種情況下,沒有觀察到低濃度樣品的 Cq 增加。

圖 11.18C.模板濃度高的樣品不在標準曲線上。這是典型的因模板濃度抑制或基線設定不正確所造成的反應。
標準曲線也用於測量反應在稀釋液動態範圍內的效率。必須注意確保所有用於效率計算的點都在該線上。反應的效率應盡可能接近 100%,並進一步調查那些表面上效率很高(>110%)或很低(<85%)的反應。

圖 11.19A.模板核酸經過 10 倍系列稀釋。擴增圖的梯度異常淺,ΔCq 為 4 循環,而非預期的 3.3 循環。

圖 11.19B.Cq 對數量的標準曲線圖的梯度可用於計算反應的效率。
| Problem | PCR 效率大於 120% (Figure 11.20) |
|---|---|
| 可能的原因 |
|
| 診斷測試 |
|
| 解決方案 |
|

圖 11.20A.模板核酸經過 10 倍系列稀釋。擴增圖間的ΔCq 為 1.5 cycles 而非 3.3

圖 11.20B.Cq 對數量的標準曲線圖的梯度可用於計算反應效率,該效率接近 140%。

圖 11.20C.檢視熔融曲線譜發現,較低濃度的樣品(黃色和藍色痕跡)也含有來自擴增引物二聚體的信號(峰值在較低的 Tm)。
故障排除 RT-PCR 案例研究
一個失敗的探針檢測
設計了一個基於探針的檢測來檢測人類 cDNA 樣本中的 EIFB1,但顯示沒有擴增。最初的反應使用相容的試劑在 ABi StepOne 儀器上進行。嘗試使用 200 nM 到 900 nM 的濃度範圍來優化引物(圖 11.21),但沒有改善。檢測設計經過驗證,發現適合目標物且在絲網中預測這是一種高品質的檢測。使用不同的操作者、SYBR Green I 试剂(因此是不同的试剂)和仪器(Eppendorf Realplex)合成了新引物,并与原始合成的等分试剂一起运行(图 11.22)。在採用這種方法時,我們注意到首要目標是解決問題,次要目標是解釋失敗原因。這個反應從兩批引物中得到了相同的擴增結果。在這個階段,反應的問題似乎出在探針上,因此合成了一個新的探針,並由第二位操作者使用 LuminoCt® 試劑(與最初試用的試劑不同)在 Realplex 儀器上比較了這兩批探針(圖 11.23)。兩個探針都產生了擴增數據,新的探針似乎比原探針稍好一些,但值得注意的是,原探針在測試實驗室之間郵寄過,因此在室溫下,在溶液中已經好幾天了。在這個階段,很明顯,當第二位操作員在 Realplex 儀器上使用 LuminoCt® 試劑進行測試時,原來的和替換的測試都能正常運作。
因此,原來失敗的其餘原因被認為是:
- 操作者: 實驗由經驗豐富的科學家重複了好幾次,因此,這被認為是不太可能的解釋。
- 儀器: 可能有一些問題,因為其他一些檢測也失敗了。
- 試劑: 最容易測試的解釋。LuminoCt® 試劑在ABi StepOne儀器上使用兩個寡核苷酸批次,由第一位操作者與現有試劑進行比較。使用原有試劑反應失敗,但使用LuminoCt® 試劑則有良好的擴增效果(圖11.24)。

圖 11.21.測試 EIFB1 的引物濃度介於 200 nM 與 900 nM 之間。在任何條件下都沒有觀察到擴增現象(寡聚體與 ABi StepOne Plus 上的 ABi 試劑)。

圖 11.22.在 SYBR Green I 試劑中比較了兩批針對 EIFB1 的引物;原本失敗的一批和新的一批。(寡聚物和試劑在 Eppendorf Realplex 儀器上)。兩組引物都支持擴增。

圖 11.23.在 LuminoCt® 試劑中比較了兩批 EIFB1 的引物和探針;原本失敗的一批和新的一批。(寡聚物和試劑在 Eppendorf Realplex 儀器上)。兩組寡聚體都支持擴增。

圖 11.24.EIFB1 引物和探針檢測在兩種不同試劑(Original ABi 或 LuminoCt® 試劑)中運行。只有在使用 LuminoCt® 試劑運行時才會從此檢測中獲取數據。
反應效率不正確且多變
使用標準引物和探針檢測法,對人工寡聚物的序列稀釋液進行測試。該檢測最初是在不同的儀器上開發和優化的,但是轉移到不同的檢測實驗室和儀器上時,奇怪的稀釋效應卻沒有出現(圖 11.25A)。所有的檢測條件都被重新優化,以針對新的實驗室,但數據沒有改變。操作人員觀察到,在幾小時內使用相同的稀釋系列重複檢測時,效果更加明顯。作為故障排除過程的一部分,由不同的操作員在不同的儀器上進行檢測,結果同樣產生了預期的標準曲線。這導致有人認為最初的問題是由於操作錯誤、儀器故障或實驗程序中的某些細微變化造成的。由於兩位操作員都有豐富的經驗,而且儀器在其他實驗中也運作良好,因此我們檢查了細微差異的選項。一個重要的線索是觀察到相同稀釋系列的樣品在 4 °C 儲存一段時間後,其數據的差異性(圖 11.25A 和 11.25B)。這促使我們檢查用於稀釋系列的試管,並測試替代品。在改用 Eppendorf 1.5 mL 反應管進行稀釋系列後,產生了預測的標準曲線 (圖 11.25C),證明了選擇分子生物學、低殘留率的塑膠器皿進行 PCR 是非常重要的,而且這些檢測對方案中的細微變化非常敏感。

圖 11.25A.人工寡核苷酸模板稀釋 10 倍後,使用特定探針式檢測法進行檢測。擴增圖間有不一致的差異。

圖 11.25B.人工寡核苷酸模板被稀釋 10 倍(這就是圖 11.25A 中檢測到的稀釋液),並在 4 °C 下放置數小時,然後用特定探針檢測。擴增圖間存在不一致的差異,而稀釋與檢測之間的時間距離使差異更加明顯。

圖 11.25C.將人工寡核苷酸模板稀釋 10 倍放入分子生物學級的試管中,使用特定的探針式檢測法進行檢測。擴增圖間有一致的差異,一如預期。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。