分析基因表達的一種方法是測量基因的 mRNA 濃度。這種分析有幾個挑戰,例如不同轉錄本之間的半衰期差異、轉錄的時間模式以及 mRNA 和蛋白質之間缺乏相關性。要使用以 PCR 為基礎的方法分析 RNA,必須使用反轉錄 (RT) 製作 cDNA。
RT步驟可以在總RNA上進行,這樣就產生了代表許多轉錄本的全局cDNA(通常通過兩步協議),或者在基因特異性方法中,只將感興趣的RNA轉換成cDNA(通常遵循一步協議)。
由於已證實兩步式 RT 反應在輸入 RNA 和 cDNA 產量方面並不總是線性的1,因此確定和控制提取並包含在 RT 反應中的 RNA 總量是很重要的。測量 RNA 的濃度會產生不確定性,絕對值取決於用來進行測量的儀器或系統。從 圖 8.1, 5 個 RNA (A-E) 樣本的濃度測量之間有很大的差異 (see Sample Purification and Quality Assessment)時使用 Nanodrop、傳統 UV 分光光度法、Ribogreen、Agilent 2100 BioAnalyzer 或 Bio-Rad Experion。請注意,EDTA(樣本 D 和 E)的存在會抑制下游 RT 和 PCR,而降解(樣本 C)則會對濃度測量產生不同的影響,這取決於使用哪種系統。這一觀察說明了在下游反應中使用樣品之前執行額外質量控制步驟的重要性(參見 Sample Purification and Quality Assessment).
。
圖 8.1.使用 Nanodrop、傳統 UV 分光光度法、Bio-Rad Experion、Agilent 2100 BioAnalyzer(均為重複測量)或 Ribogreen(單次測量)測量五個樣本的總 RNA(A-E)濃度。可以看出,不同樣品的絕對濃度和相對濃度都有所不同。這是因為樣本 C 已降解,而樣本 D 和 E 含有 EDTA,導致 Experion 和 BioAnalyzer 系統的測量結果不準確。

圖 8.2.總 RNA 稀釋 100 倍,使用兩步隨機引物進行反轉錄;進行兩次獨立的 RT 反應。在每個 RT 反應的重複 qPCR 中檢測 β-actin。RT 可重複進行,但 cDNA 產量與輸入的 RNA 濃度不成比例。因此,如果實驗限制要求在 RT 中加入不同濃度的 RNA,則驗證方案和試劑組合是否能產生線性反應至關重要。
在 圖 8.3中,ReadyScript® RT試劑(RDRT)被用來反轉來自2倍和10倍序列稀釋模板的總RNA,使用兩步協議和 oligo-dT (O4387)和隨機引物的組合(如下所述)。在這兩個稀釋系列中都可以檢測到 CANX 基因,其濃度與輸入的 RNA 濃度成正比。

圖 8.3.ReadyScript® RT 試劑 (RDRT) 用於反轉錄自 2 倍和 10 倍序列稀釋的總 RNA。在兩個稀釋系列中均檢測到基因 CANX,結果與輸入的 RNA 濃度成正比(數據來自參加 EMBL 進階 qPCR 研討會的學生小組)。
反向轉錄引物
用於啟動反向轉錄的引物的選擇會在很大程度上影響 RT-qPCR 結果。對於一步法
RT-qPCR,使用基因特異性引物。當進行兩步檢測時,可使用反向基因特異性引物、oligo-dT (O4387)、隨機六元引物、九元引物、十元引物、十二元引物或五元引物2 或結合使用 oligo-dT (O4387)和隨機引物。基因特異性引物通常針對每個目標 RNA 在不同的反應中進行。這些獨立的反應可能有非常不同的效率,因此使 RNA 濃度之間的比較變得複雜。另一方面,當使用基因特異性引物時,所有的 RT 產物都會編碼感興趣的基因,因此可以定量使用非特異性 RT 引物無法偵測到的低豐度 mRNA。為了避免基因特異性引物在 RT 測試中可能出現的高測試間差異,可使用非特異性引物來產生 cDNA 池。隨後可使用 cDNA 池中的等分樣本對每個目標進行獨立的 qPCR 分析。如果所有的 qPCR 目標都靠近多聚腺苷酸化 mRNA 的 3'-end 部分,oligo-dT (O4387) 是合適的引物選擇。另一方面,如果 qPCR 目標距離 3'- 端超過幾個千位元組,或者 RNA 未經多聚腺苷酸化,則隨機引物會帶來更可靠的檢測結果。如果 qPCR 目標的相對 3' 位置不同,或者所需的轉錄本包含多聚腺苷酸和非多聚腺苷酸 RNA 的組合,則 oligo-dT (O4387) 和隨機寡聚體的混合物將獲得最佳結果
兩步 RT 引物通常使用兩種方法; oligo-dT (O4387) 和隨機引物。 oligo-dT(O4387)方法依靠 oligodT(通常是 15mer)與存在於大多數 mRNA 分子 3' 端的 poly-A 尾部雜交,以引物和選擇性地反向轉錄 mRNA。
這種方法雖然在概念上非常簡單,但存在相關的挑戰:在 RT 所用的反應溫度下, oligo-dT (O4387) 引物與 mRNA 的結合並不是特異性的,因此 oligo-dT (O4387) 會非特異性地與 RNA 的其他區域結合。此外,rRNA 的片段也會被檢測到,因為這些分子中的 ATrich 區域會被 oligo-dT (O4387) 引導。
第二種方法使用隨機引物。隨機引物由隨機序列組成,通常是六聚體(6mer)或非聚體(9mer)。這些引物用於啟動 RT 反應,從而合成代表原始 RNA 的不同長度的 cDNA 片段。隨機引物沿著轉錄本的長度進行雜交,往往比 oligo-dT (O4387) 或基因特異性引物更能容忍次級結構。
為了受益於各自技術的優點,有些方案需要結合兩種引物類型。目標序列的特異性引物也可能用於兩步 RT 方案,但更常用於一步程序(見下文)。
一步法 RT 反應的反轉錄引物
在一步法 RT 規範中,基因特異性引物用於反轉錄單一靶點。基因特異性引物的設計至關重要;當在 RT 反應的溫度下預測時,它必須位於 mRNA 目標的開放、可訪問區域內。在這些條件下,輸入的 RNA 與 cDNA 之間有線性關係(圖 8.4)。此引物可能(通常也是)與 PCR 引物共用。

圖 8.4.總 RNA 經 10 倍稀釋系列稀釋,並進行一步 RT-qPCR 檢測 GAPDH。每個反應進行一式三份。這導致 RNA 濃度與 cDNA 產量呈現線性關係(圖片由英國 Anglia Ruskin University Stephen Bustin 教授提供)。
反轉錄是一個變化極大的過程,所有步驟都必須考慮到盡可能保持反應成分的穩定。進行一步式 RT-qPCR 反應可減少所需的移液步驟,並減少誤差。因此,如果需要測量微小的差異,而且準確性是最重要的,它可能是首選的方法。然而,相反的考慮因素是,興趣基因 (GOI) 與參考基因比率的釐定 (see 資料分析)需要兩個獨立的一步式 RT 反應,而不是兩步式反應的單個 cDNA,而且使用多重 qPCR 方法無法檢測到兩個目標。
反转录效率
一般假設 RT 反應中所有的 RNA/mRNA 都轉換成 cDNA,而且所有的轉錄本都以 1:1 的比例或與起始 RNA 濃度成正比。最近有研究對這些假設逐一進行調查。很明顯,轉換成 cDNA 的 RNA 量變化很大。兩個步驟的 RT 過程是多變的,特別取決於 RNA 濃度、酵素、緩衝液成分和引物協議。
對於兩步 RT 反應,一般而言,必須以相同的輸入 RNA 濃度為目標,並保持引物條件、RT 酵素和緩衝液不變。當無法確定恆定的輸入濃度時,建議使用一步法,加入載體如 Polyethylene Glycol (PEG)6,或選擇經過驗證可產生線性反應的商業試劑盒,如 ReadyScript® RT。
引物策略的選擇會影響總 RNA 樣本中不同 cDNA 目標的絕對產率和比率。 圖 8.5 顯示了同樣經過控制、酵素降解的 RNA 樣本中三個不同基因的 cDNA 拷貝數產率(以直方圖的顏色顯示)。很明顯,不同的引物方法會產生不同的絕對拷貝數和樣本間的比率。此外,基因特異性引物似乎比 oligo-dT 引物更能忍受 RNA 的降解。

圖 8.5.使用基因特異性、隨機或 oligo-dT (O4387) 引物製備 cDNA。如紫色、綠松石色和橙色直方圖所示,三個基因的拷貝數已被測定。很明顯,不同的引物策略會影響每個基因的檢測,oligo-dT (O4387) 引物會導致檢測不到基因 3(橘色),而基因 3(橘色)在 RNA 樣本中很明顯,因為它是使用基因特異性引物檢測到的(數據由英國 Anglia Ruskin 大學 Stephen Bustin 教授提供)。
RT反應所使用的溫度可能會影響特異性,尤其是與基因特異性引物進行雜交時。能形成強 3'-duplex 的引物在較低溫下會更容易雜交。由於 RT 酵素可從 DNA 模板上的 DNA 引物延伸,引物二聚體的形成可能會在 RT 步驟中開始。將 RT 溫育溫度提高到酵素完全活躍的最高溫度,或使用高溫酵素,可能會減少引物二聚體的產物量。 圖 8.6 中使用的引物在 45 °C用Moloney Murine Leukemia Virus-Reverse Transcriptase (MMLV-RT)進行RT時(圖 8.6B)比在 37 ℃ 進行 RT 時(圖 8.6A)的結果好。同樣地,使用非特異引物進行 RT 並使用 Hot Start Taq 聚合酶進行 qPCR 的兩步 RT-qPCR,比使用可形成 3'-duplex 的基因特異引物的一步 RT-qPCR(圖 8.6B)產生較少的引物二聚體產物(圖 8.6D).
。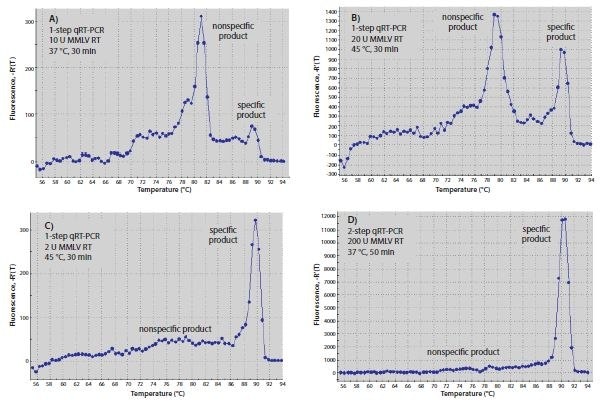
圖 8.6.RT 的最佳化。(A-C)一步式或(D)兩步式 RT-qPCR 產生的 RT-qPCR 產品的熔解曲線。反應 A-C 各含 10 μL SYBR® Green JumpStart™ Taq ReadyMix™、0.02 μL 參考染料、0.4 μM 的兩種基因特異性引物和 10 ng 人類總 RNA,最終容量為 20 μL。基因特異性引物為 5'-CGGGCTTCAACGCAGACTA-3´ 和 5´ -CTGGTCGAGATGGCAGTGA-3´ (Accession NM_005252)。反應 A 和 B 也含有 20 個單位的 MMLV- RT,而反應 C 則含有 2 個單位。反應 A 在 qPCR 前於 37 ℃ 培養 30 分鐘,而 B 和 C 則在 qPCR 前於 45 ℃ 培養 30 分鐘。在 D 中,RT 反應包含 1x MMLV 緩衝液(產品編號 D8559)、0.5 mM dNTPs、1 μM oligo-dT (O4387)、0.8 單位/μL RNase 抑制劑、200 單位 MMLV-RT 和 10 ng 人類總 RNA,最終容積為 20 μL。將 2 μL RT 反應產物加入含有 10 μL SYBR® Green JumpStart™ Taq ReadyMix™ 0.02 μL 參考染料的 qPCR 中,兩種基因特異性引物的濃度均為 0.4 μM,與一步式反應相同 (A-C)。所有 qPCR 反應均在 94 °C 溫育 3 分鐘變性,然後進行 40 個 94 °C 15 秒和 60 °C 1 分鐘的循環。
每次反應的 RT 酶量也會影響 RT-qPCR 結果。如 圖 8.6所示,使用 2 個單位 MMLV-RT 的一步反應(圖 8.6C)比使用 20 個單位的反應(圖 8.6B)更具特異性。使用oligo-dT (O4387)或隨機引物進行兩步RT-PCR比一步RT-PCR的特異性更高(圖8.6D)。這可能是由於基因特異引物在低溫 RT 反應中不存在,從而防止了非特異產物的形成。在兩步反應中,較高濃度的 RT 可能會得到較好的結果,但由於 RT 酵素可能會干擾 Taq DNA 聚合酶的活性7,因此轉移到 qPCR 的 RT 產物量應該限制在不超過最終反應容量的 10%。此建議的例外情況是使用 ReadyScript 時,PCR 試劑量的 25% 可以是 RT 反應而不影響 PCR 效率。
以上對RT過程中固有變數的描述,說明了RT對基因
表達的測定,除了要考慮模板的數量外,還取決於所使用的RT方法、樣本的數量和質量,並應小心報告,如MIQE指南8 (see 定量 PCR)。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?