Nitrozamin szennyeződések vizsgálata LC-MS módszerekkel az Egyesült Államok Gyógyszerkönyvének általános fejezetéből <1469>
Tim Mueller, Site Management-Analytical, Patrik Appelblad, Senior Principal Scientist
Merck
Bevezetés
A nitrozaminok számos anyagban jelen lévő nemkívánatos melléktermékek, amelyekről feltételezhető, hogy mérgező és rákkeltő tulajdonságokkal rendelkeznek. A gyógyszeripari nyersanyagokban és a kész gyógyszerkészítményekben nitrózaminok a szintézis során, a tárolás során, vagy a csomagolásból stb. származó melléktermékként is képződhetnek. A nitrózamin-analízis iránti igény világszerte gyorsan nőtt. Az egyes szintetikus útvonalakon előállított gyógyszerhatóanyagokból előállított nitrózamin szennyeződések listája a kiterjedt szintetikus útvonalvizsgálatok után egyre bővült.
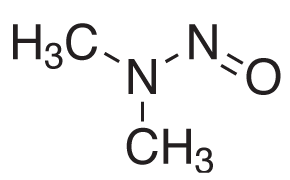
1. ábra.Az N-nitrozodimetilamin (NDMA) kémiai szerkezete.
Az Egyesült Államok Gyógyszerkönyve (USP) 2021 decemberében új eljárásokat tett közzé, válaszul a nitrozaminok, például az N-nitrozodimetilamin (NDMA) szennyeződés, 1. ábra váratlan kimutatására egyes gyógyszerhatóanyagokban (API) és a megfelelő végleges formulákban.1 Az új USP <1469> fejezet ajánlásokat tartalmaz a nitrózamin szennyeződések határértékeinek ellenőrzésére vonatkozóan a nitrózaminok eliminálásának vagy csökkentésének biztosítása érdekében, valamint az analitikai módszerek teljesítményjellemzőit a nitrózamin-vizsgálati eljárásokra vonatkozóan, mind a GC-MS (2. és 4. eljárás), mind az LC-MS (1. és 3. eljárás) alkalmazásával.
Ez a cikk az LC-MS alapú vizsgálati eljárásokkal (1. és 3. eljárás) foglalkozik a gyógyszerekben és gyógyszeripari nyersanyagokban található ismert nitrózamin szennyeződések mennyiségi elemzésére folyadékkromatográfiás és tömegspektrometrikus detektálással. Bár mindkét módszert értékeltük, a végső futtatási feltételeket és a 3. eljárás adatait mutatjuk be. Az 1. eljárás rendszeralkalmassági kritériumait a rendelkezésre álló műszerekkel nem lehetett teljesíteni, de ismertetésre kerülnek.
Az 1. eljárás nagy felbontású tömegspektrométer (HRMS) használatát jelöli ki, és az NDMA, NDEA (nitrózodietilamin), NDBA (nitrózodibutilamin), NDIPA (N-nitrózodiizopropilamin) mennyiségi meghatározására használható, NEIPA (N-nitrozoetilizopropilamin), NMBA (N-nitrozometilaminovajsav) és NMPA (N-nitrozometilfenil-amin) kimutatására kiválasztott szartánokban (valsartán, irbezartán és lozartán-kálium). A 3. eljárás MS/MS-t használ, és az NDMA, NDEA, NDIPA, NEIPA, NMBA és NDBA mennyiségi meghatározására használható a kiválasztott szartánokban (valsartán, losartán kálium, olmesartan medoxomil, candesartan cilexetil és telmisartán).
Kísérleti feltételek
Minta és standardok előkészítése
A felhasznált standard és mintaoldatokat a következőképpen készítettük:
- Belső standard oldat: 10 μg/ml NDMA-d6 és NMBA-d3, valamint 1 μg/ml NDEA-d10 és NDBA-d18 egyenként vízben készült
- Nitrozamin standardok törzsoldatkeveréke: Az NDMA, NEIPA, NDIPA, NDBA és NMBA egyenként 200 ng/mL-t tartalmazó keveréket a megfelelő USP-referenciastandardok megfelelő térfogatának összekeverésével és vízzel hígítva készítettük el.
- NDEA standard törzsoldat: Az NDEA 132 ng/mL oldatát az USP N-Nitrozodietilamin RS vízzel történő hígításával készítettük.
- Standard oldatok: A minta nitrózamin célzott nitrózamin-koncentrációjától függően 5 egymást követő linearitási oldatsorozatot készítettünk a 1. táblázat -ban leírtak szerint a nitrózamin-standardok törzsoldatkeverékéből és az NDEA standard törzsoldatból, az egyes oldatok meghatározott térfogatainak a megadott módon történő összekeverésével.
- A mintákat a következőképpen készítettük el:
- 80 mg hatóanyagot egy 2 mL-es, fedeles, centrifugacsőbe töltöttünk.
- 1188 μL hígítószer (1%-os hangyasav vízben) és 12 μL belső standard oldat hozzáadása.
- 20 percig 2500 rpm-en történő vortexelés (kivéve a lozartán-káliumot, amelyet 5 percig kell vortexelni NMT).
- Centrifugálás kb. 10 000 rpm-en 10 percig
- Szűrés egy fiolába 0,45 µm pórusméretű PTFE szűrővel.
Valsartan minták
A valsartan mintaoldatot a mintaelőkészítési protokoll szerint készítettük el. A 8. táblázatban a "valsartan" a gyógyszerkészítményt (tabletta/tabletta por) jelenti.
Lozartán minták
A lozartán mintaoldatot a mintaelőkészítési protokoll szerint készítettük. A 10. táblázatban szereplő "losartán" a losartán tablettának vagy őrölt losartán tablettának felel meg
LC-MS (3. eljárás)
A szétválasztásokat egy Agilent 1290 Infinity II HPLC-rendszeren (Agilent, Waldbronn, Németország) végeztük, amely egy APCI-forrással rendelkező 6495C hármas négypólusú MS-detektorral volt felszerelve. A kromatográfiás elválasztásokat gradiens üzemmódban végeztük egy Ascentis® Express C18 (USP L1 Packing) 150×3,0 mm I.D., 2,7 µm oszlopon (lásd 2-4. táblázat).
Adatok kezelése
Az adatgyűjtés és -feldolgozás a Masshunter szoftver 10.0 verziójával történt.
Eredmények és megbeszélés
Az 1. eljárás értékelése
Az USP 1. eljárás módszere folyadékkromatográfia és nagyfelbontású tömegspektrometriai detektálás (LC-HRMS) alkalmazását írja le, de a megadott kísérleti feltételek1 nem tűnnek elég általánosnak ahhoz, hogy bármely adott HRMS-platformon megvalósítható és validálható legyen. Laboratóriumunkban érzékenységi problémákat tapasztaltunk egy ultramodern HRMS-detektorral (Agilent 6546 Q-TOF), és az eredmények ellenőrzésére különböző HPLC-oszlopokat, oldószereket és reagenseket teszteltünk. A kromatográfiás rendszer alkalmassági kritériumok teljesíthetők voltak, de az általános azonosítás és érzékenység tekintetében nem sikerült teljesíteni a rendszer alkalmasságát.
Ezzel összehasonlítható jelintenzitást értünk el 1 µg/ml, 100 ng/ml és 50 ng/ml esetén az NDEA, NEIPA, NDIPA, NDBA és NMPA esetében (ESI pozitív üzemmódban) Supelco® L43 oszlop (Ascentis® Express F5), lásd 2. ábra és két másik gyártó L43 oszlopával (nem látható). Az NDMA szennyeződést SEMMELYIK oszlopon nem mutatták ki semmilyen koncentrációban, és az NMBA-t egyik oszlopon sem mutatták ki ESI(-) üzemmódban. A különböző L43 oszlopok (propil spacerrel a szilika részecskékhez kémiailag kötött pentafluorofenil csoportok) összehasonlítása az LC-HRMS készülékkel az 1. eljáráshoz hasonló általános viselkedést mutatott, de a rendszer azonosításra és érzékenységre való alkalmasságának nem lehetett megfelelni. A közelmúltban az USP Pharmacopeial Forum (USP-PF) oldalán további pontosítások jelentek meg az 1. eljárással kapcsolatban. Ez megemlíti, hogy az elemzéseket Orbitrap Fusion Lumos Tribrid márkájú tömegspektrométerrel végezték és validálták. Mivel laboratóriumunkban nem állt rendelkezésre ilyen típusú műszer, az 1. eljárás további validálására nem került sor.
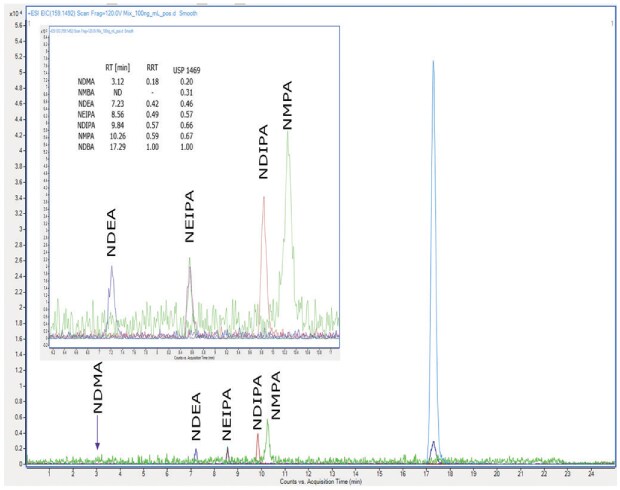
2. ábra.100 ng/ml nitrozamin-keverék kromatogramja Supelco® L43 oszlopon (Ascentis® Express F5), ESI(+) üzemmódban elemezve.
A 3. eljárás értékelése
Ez a módszer folyadékkromatográfiás és tandem-tömegspektrometrikus detektálással (LC-MS/MS) történő meghatározást ír le az NDMA, NDEA, NDIPA, NEIPA, NMBA és NDBA mennyiségi meghatározására kiválasztott szartánokban (valsartán, lozartán-kálium, olmesartan medoxomil, candesartan cilexetil és telmisartán). Az eljárás két rendszeralkalmassági kritériumot sorolt fel: 1. Korrelációs együttható: NLT 0,99 és 2. y-intercept: Legfeljebb (NMT) 25%-a a standardgörbe előállításához használt közepes koncentrációjú oldat válaszának. A továbbiakban a validált analitikai eljárást 3 létrehozó munkából származó analitikai adatok kerülnek bemutatásra, amely egy 150 x 3,0 mm-es Ascentis® Express C18 oszlopot (USP L1 csomagolás) használ 2,7 μm-es részecskékkel. A 3. ábra egy nitrozamin szennyezőanyag-standard példáját mutatja be ezen az oszlopon.
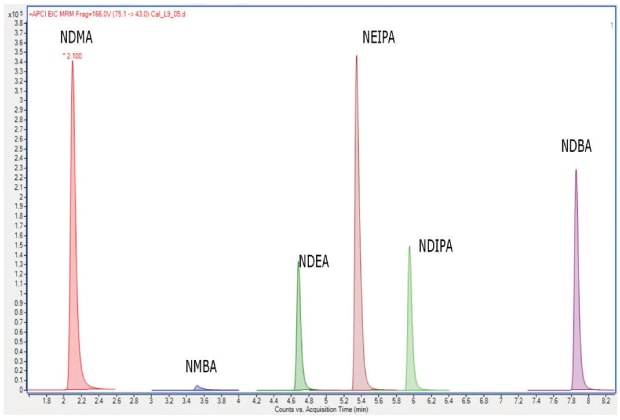
3. ábra.MRM kromatogram (skálázás nélkül) 90 ng/mL nitrozamin standard oldatról Ascentis® Express C18 oszlopon a 3. eljáráshoz.
A módszer linearitását kilenc kalibrációs szinten határozták meg a műszeres beállítás optimalizálása után. Minden linearitási oldatból háromszoros injektálást végeztünk. Az USP <1469> fejezete két rendszeralkalmassági követelményt határozott meg a 3. eljáráshoz. A korrelációs együttható nem lehet kisebb, mint (NLT) 0,99, és az egyes kalibrációs grafikonok y-interceptje nem lehet több, mint (NMT) 25%-a a standardgörbe előállításához használt közepes koncentrációjú oldat válaszának. Amint az 5. táblázat mutatja, mindkét követelmény teljesült.
A módszer precizitását (6. táblázat) és pontosságát (7. táblázat) az 1., 5. és 9. kalibrációs szint (L1, L5 és L9) tíz injekciójának adatai alapján határoztuk meg. Az 1., 5. és 9. szintű oldatok pontosságát az 1. táblázatban leírt 9 pontos kalibrációs görbék segítségével számoltuk ki.
A módszer kimutatási határát (LOD) és a mennyiségi meghatározás határát (LOQ) úgy határoztuk meg, hogy 3,3 ng/ml (2,2 ng/ml NDEA esetében) valsartán/losartán mintaoldatba spicceltünk, és a jel-zaj (S/N) arányt használtuk a számításhoz. A kimutatási határértéket 3 jel/zaj S/N-arányként, míg a mennyiségi meghatározás határát 10 S/N-arányként határozzuk meg. Az S/N-arányt a műszer szoftverével számították ki, és ahol az S/N-arányt minden egyes csúcshoz automatikusan állapították meg a csúcsmagasság és egy meghatározott zajterület alapján. A mért mintákra kapott határértékeket a 8-11. táblázat mutatja be.
A módszer specificitását az analitok retenciós idejének és az NDBA retenciójához viszonyított relatív retenciójának megfigyelésével határoztuk meg a nitrózamin standard oldatok (n=40) injekcióinak sorozatában.
A módszer specificitását az analitok retenciós idejének és az NDBA retenciójának megfigyelésével határoztuk meg.Az analit visszanyerését egy valzartán- és egy lozartán-kálium-tételben határozták meg (13. táblázat). A hatóanyag-tételeket a mintaelőkészítési eljárás során három koncentrációban, háromszorosított példányban spicceltük az összes analitot. Az elkészített mintaoldatokat egy külső kalibrációs görbe alapján mértük és értékeltük ki az egyes analitkoncentrációk kiszámításához. A belső standard jel és az analit jelének arányát a mintaoldatban és a (külső) kalibrációs sor oldataiban határoztuk meg, azaz jel NDMA-D6 / jel NDMA. Ezután a jelarányokat használtuk a mintaoldatban lévő koncentráció kiszámításához a kalibráló oldatokkal szemben.
Az analit visszanyerésének meghatározása során szisztematikus problémát figyeltek meg az NDBA tüske visszanyerésének meghatározásával kapcsolatban (az adatok nem láthatóak), mivel az analit talált koncentrációi mindig túl magasak voltak (visszanyerés > 130%, ezért kizárták).
A probléma lehetséges okainak elemzése azt mutatta, hogy az NDBA elúciója során egy vagy több ismeretlen anyaggal való koelúció történik.
Következtetés
Ez a cikk az USP <1469> fejezetével, az 1. eljárással végzett munka érdekes eredményeit, valamint a 3. eljárás sikeres, a rendszer alkalmasságának minden követelményét kielégítő végrehajtását mutatja be.
A valsartánban lévő N-nitrozaminok GC-MS/MS módszerrel történő meghatározásáról lásd a N-nitrozaminok meghatározása a valszartánban
A gyógyszeripari minőség-ellenőrzés témakörében további információkat talál a SigmaAldrich.com/PharmaQC
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?