Tipy pro imunofluorescenční protokoly
Přečtěte si více o
- Imunodetekce s fluorescenčními protilátkami
- Fluorescenční imunodetekce pro ICC: Krok za krokem
- Výběr protilátek a fluoroforů
- Další úvahy při výběru fluoroforů
- Program ochrany fluorescence: Prodlužte životnost svých fluorescenčních protilátek a činidel
- Výběr protilátek: Výběr protilátek: Technika barvení
- Výběr protilátek: specifická reaktivita
- Experimentální kontroly pro IF-ICC
- Experimentální kontroly pro IF-ICC Zasvěcené rady pro získání nejlepšího signálu - a překonání pozadí - pomocí IF-ICC
- Související produkty
Imnoznačení pomocí fluorescenčních protilátek
Použití imunofluorescence (IF)-.kdy je protilátka konjugována s molekulou, která po excitaci laserem fluoreskuje - patří lokalizace proteinů, potvrzení posttranslační modifikace nebo aktivace a blízkost/komplexace s jinými proteiny. Imunocytochemie (ICC) je dobře zavedená technika, která používá protilátky k vazbě na cíle ve vzorcích buněk, a Coons et al poprvé popsali imunodetekci pomocí fluorescenční reportérové molekuly v roce 1942. Kromě toho, že kombinace imunofluorescence s imunocytochemií poskytuje informace o subcelulárních cílech, vytváří některé z nejpřesvědčivějších vizuálních dat v přírodních vědách. V tomto průvodci se vědci zabývající se protilátkami podělí o to, co jsme se naučili o tom, jak získat co nejlepší obraz z vašich experimentů IF-ICC.
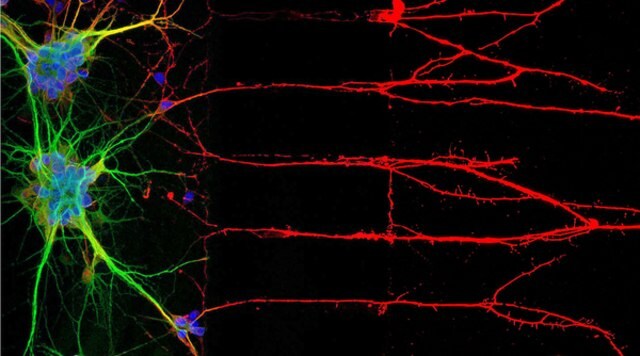

Obrázek 1: Imunocytochemie (ICC) lokalizuje proteiny spojené s jádry, somou a axony neuronů (vlevo). Vpravo imunofluorescenční barvení lidské buněčné linie U-251 MG.

Obrázek 2.Fluorescenční imunodetekce
Pro dosažení nejlepších výsledků může být nutné optimalizovat některé kroky imunofluorescenčního protokolu na základě faktorů, mezi které patří subcelulární umístění cíle a vlastnosti antigenu.
Příprava vzorků:
Bez ohledu na formát růstu buněk začíná úspěšné zobrazování IF-ICC sklizní zdravých vzorků při vhodné hustotě kultury.
Suspenze buněk:
Buněčné typy mohou být promyty, aby se odstranila média, a resuspendovány, poté obarveny ve zkumavkách s malým objemem před upevněním na sklíčka pro mikroskopické vyšetření. Suspenze by měly být nejprve mikroskopicky vyšetřeny z hlediska morfologie a neměly by překročit doporučenou konfluenci/titer pro buněčnou linii, aby byly považovány za vhodné pro imunocytochemii. Zdravé, subkonfluentní kultury nebudou nadměrně zakalené ani nebudou vykazovat žluté zbarvení, které by ukazovalo na okyselení média. Buňky by se měly při mikroskopickém vyšetření jevit jako světlé a zaoblené. Procento životaschopnosti lze stanovit pomocí hemocytometru a vyloučení trypanové modři. Po promytí by měly být buňky resuspendovány v množství 1 -2 x 106 buněk/ml, ať už pro barvení ICC v roztoku, nebo pro nanášení nátěru pro následné barvení na sklíčka speciálně upravená pro zvýšenou adhezi buněk.
Při adherentních buňkách kultivaci (a případně ošetření) za účelem zkoumání vlivu na expresi cíle pomocí IF-ICC lze buňky nasadit na komůrková sklíčka, což jsou sklíčka optimalizovaná pro optické zobrazování s připevněnými jedno- nebo vícekomůrkovými nástavbami, které umožňují přidání média pro kultivaci. Komorová sklíčka umožňují přímý přechod z buněčné kultury na zkoumání a zobrazování. Adherentní typy buněk lze také vysévat na krycí sklíčka mikroskopů ponořená do jamek naplněných médii, která se následně obarví a upevní na sklíčka pro zobrazování.
Bez ohledu na kultivační povrch a přístup k nádobám je třeba pečlivě sledovat růst buněk na krycích sklíčkách nebo v komůrkách se sklíčky, aby bylo možné buňky vyjmout z kultury a fixovat pro imunocytochemii dříve, než dojde k jejich přerůstání. Buňky se často zobrazují, když je konfluence (plocha povrchu pokrytá buňkami) v rozmezí 50-80 %. Pokud je třeba před imunobarvením definitivně určit životaschopnost buněk, někteří výzkumníci používají barviva, jako je ethidium homodimer., jaderný marker, který nemůže projít neporušenými buněčnými membránami živých buněk - takže barvení pomocí DAPI, který fluoreskuje v jádrech životaschopných i neživotaschopných buněk, může pomoci vyčíslit procento životaschopnosti jako počet jader obarvených etidiem/počet jader obarvených dvojmo. Alternativně jsou k dispozici komerční soupravy pro rozlišení živých a mrtvých buněk, které často používají kalcein a propidium jodid k rozlišení živých a mrtvých buněk.
Fixace:
Fixace a permeabilizace lze dosáhnout v jednom kroku pomocí organických fixativ, jako je alkohol a aceton. Organická rozpouštědla by se však neměla používat, pokud je třeba zachovat integritu lipidů, jako například v případě, kdy je cílový antigen spojen s membránou. Ačkoli formaldehyd (často prodávaný a používaný ve své polymerní formě paraformaldehydu) je běžnou volbou, která zastavuje rozklad a fixuje proteiny na místě, zesíťující aldehydy mohou bránit přístupu protilátek k některým antigenům, a proto by se měly používat v nejnižší koncentraci, která účinně zachová strukturu po 10-20 minutách inkubace, obvykle mezi 1-4 % pro (para)formaldehyd. POZNÁMKA: Protože je zdrojem autofluorescence, je lepší se glutaraldehydu ve fixačních protokolech IF vyhnout.
Vyhledání antigenu:
Některé cílové epitopy mohou být maskovány tím, že jsou komplexovány v přeplněném buněčném mikroprostředí, nebo fixačními technikami. Bylo prokázáno, že techniky vyhledávání antigenu zlepšují přístup protilátek k určitým cílovým antigenům, ale měly by být používány s nejvyšší opatrností a předem vyzkoušeny při práci s buňkami na sklíčkách, protože tepelné nebo chemické podmínky, kterým vystavují buňky, jsou obvykle příliš drsné pro vzorky ICC.
Permeabilizace:
K účinné permeabilizaci fixovaných buněk se běžně používají detergenty typu Triton-X nebo Tween-20, které však nerozlišujícím způsobem rozpouštějí lipidy a mohou být destruktivnější než saponin, glykosid rostlinného původu, který perforuje membránu selektivním rozpouštěním cholesterolů a ponechává membrány organel v podstatě neporušené. Pokud se cíl zájmu nachází v membránových strukturách uvnitř buňky, je pravděpodobnější, že přístup k protilátce zajistí silnější detergenty, jako jsou Triton-X, Tween-20, detergenty Brij nebo NP-40. Saponin je jemnější permeabilizátor, který zachovává integritu povrchových antigenů, ale nemusí být vhodný pro permeabilizaci intracelulárních membrán, aby umožnil přístup protilátek k cílům v jádře nebo jiných organelách. Protože účinky saponinu mohou být reverzibilní, a proto se mohou ztratit při promývání, mělo by se jeho použití zachovat po celou dobu barvicího protokolu, aby se zajistil přístup protilátky.
Blokování:
Roztok až 5 % normálního séra z druhu, ve kterém je sekundární protilátka chována, účinně zablokuje její nespecifickou vazbu. Pokud sérum není k dispozici, přístupem, který se přizpůsobí jakékoli sekundární protilátce, je použití obecnějšího proteinového blokátoru, jako je hovězí sérový albumin (BSA) v podobném ředění v PBS. Některé laboratoře používají kombinaci séra a BSA, aby dosáhly jak blokování specifického pro hostitele protilátky, tak obecného blokování. BSA se často dodává lyofilizovaný a rekonstituovaný do tekutiny, takže by měl být filtrován a/nebo pravidelně kontrolován, zda neobsahuje částice, které se mohou usazovat na vzorcích a vytvářet artefakty barvení. Blokování lze udržovat po celou dobu imunofluorescenčního protokolu ředěním protilátek v blokovacím pufru.
Výběr protilátek a fluoroforů
Výběr fluoroforů
.Při plánování jakéhokoli fluorescenčního experimentu zkoumajícího buňky pomocí ICC je vždy třeba nejprve zvážit optickou konfiguraci mikroskopu, který bude pro analýzu použit. Protokoly IF-ICC mohou být použity ke značení jediného cíle, ale mnoho konfigurací fluorescenčních mikroskopů umožňuje multiplexování nebo současné barvení několika cílů spolu s jádrem. Níže je uvedena ukázková experimentální paleta pro barvení tří cílů a jádra:
.
| Spektrální rozsah (kanál) | Excitace (typický vrchol nm) | Emise (typický pík nm) | Obvyklé fluorofory | Cíl | Subcelulární umístění |
|---|---|---|---|---|---|
| UV | 340-370 | 460 | DAPI, Hoechst | DNA | Jádro |
| Zelená | 488 | 520 | FITC, různé 488 | Cíl 1 | Jakýkoli (jaderný, cytoplazmatický, membránový) |
| Žlutooranžově červený | 550-575 | 605 | TRITC, Cy3 | Cíl 2 (i.e., strukturní protein) | jakýkoli |
| Další červená | 640-650 | 670 | APC, Cy5, různé 647 | Cíl 3 (tj.e., membránový marker | jakýkoli |
Fluorescenční mikroskopy mají jedinečné konfigurace pro excitaci a emisi. Mikroskopy jsou z výroby vybaveny zdroji světla s vysokou intenzitou, jako jsou obloukové lampy nebo lasery, které vyzařují světlo o specifické vlnové délce schopné excitovat kompatibilní fluorofory. Sady filtrů zachycují rozsah vlnových délek světla vyzařovaného excitovanými fluorofory, který může být široký, aby se maximalizovala zachycená emise, nebo úzký, aby se optimalizovala specifičnost a omezilo překrývání emisních kanálů. Výše uvedená tabulka je uvedena jako příklad založený na běžných konfiguracích fluorescenčních mikroskopů. Prosíme, abyste se poradili s konfigurací laseru a filtrů vašeho přístroje, abyste si mohli vybrat nejlepší protilátky konjugované s fluoroforem pro váš imunofluorescenční ICC nebo IHC protokol. Vědci z mikroskopického jádra jsou často užitečným zdrojem informací pro návrh IF experimentu.
Další úvahy při výběru fluoroforů
Fotostabilita: Fotobleaching neboli nevratné poškození fluoroforů způsobené světlem, které ovlivňuje jejich schopnost fluoreskovat, může být důsledkem nadměrného vystavení fluorescenčních molekul okolnímu světlu nebo excitaci během mikroskopie. Mnoho všudypřítomných fluoroforů, jako jsou FITC a TRITC, je široce dostupných, protože nejsou patentované a díky své dlouhé životnosti na trhu - ale mohou být mnohem citlivější na fotobleaching než fluorofory pozdější generace, které používají jiné chemické látky.
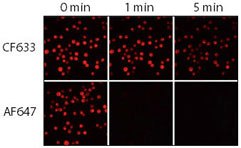
Obrázek 3.Relativní fotostabilita konjugátů CF633 a Alexa Fluor 647 (AF647) proti kozím myším. Buňky Jurkat byly fixovány, permeabilizovány a obarveny králičí anti-CD3 a následně konjugáty CF633 nebo Alexa Fluor® 647 kozího anti-králičího IgG. Vzorky byly zobrazeny pomocí mikroskopu se rtuťovou obloukovou lampou vybaveného sadou filtrů Cy5 a CCD kamerou. Sekvenční snímky byly pořízeny v časech 0, 1 a 5 minut.
Při výrobě ředěných pracovních roztoků protilátek obsahujících fluorescenční sondu zvažte ředění tohoto pracovního roztoku v nádobě chránící před světlem, například v jantarové lahvičce. Pracovní roztoky jsou často vystaveny světlu po delší dobu než skladované zásobní roztoky nebo komerční přípravky protilátek, takže toto dodatečné opatření, které snižuje expozici světlu, může poskytnout dodatečnou ochranu ve scénářích použití.
Fluorescence Protection Program:
Fluorescenční činidla mohou vyžadovat zvláštní skladování a zacházení, aby byla zachována fotostabilita fluorescenční entity i funkční integrita samotné protilátky. Ujistěte se, že činidlo dorazí za všech teplotních podmínek uvedených v přepravních dokumentech dodavatele, a přeneste je do laboratorního skladu doporučeného výrobcem, aby nebyly ohroženy světelné a teplotní podmínky. Alikvotní rozdělení zásoby protilátek při příchodu do menších objemů (s opakovaným značením) chrání integritu činidla tím, že omezuje počet případů, kdy je zásobní roztok vystaven zmrazování a rozmrazování, změnám teploty v kbelíku s ledem nebo jiným teplotním změnám nebo okolnímu světlu.
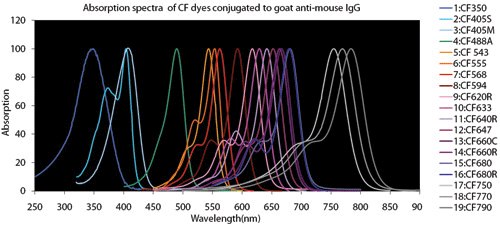
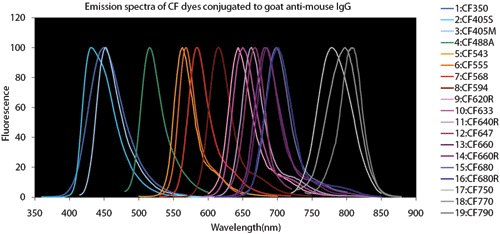
Obrázek 4.Srovnávací tabulky fluorescenčních barviv
Spektrální překryv: Při provádění multiplexních experimentů pro detekci více cílů ve stejném vzorku se řiďte spektrálními charakteristikami fluoroforů, vlnovými délkami laseru a rozsahem filtrů mikroskopu. Konfigurace emisních filtrů mikroskopu by měly být vybrány tak, aby se snížilo spektrální překrývání, ale je vhodné zvolit fluorofory, které nemají dlouhé emisní "chvosty", které by mohly pronikat do sousedního kanálu filtru.

Obrázek 5.Relativní fluorescence konjugátů CF543 a Alexa Fluor 546 (AF546) proti kozím myším jako funkce počtu molekul barviva na protein (stupeň značení).
Výběr protilátek:
Výběr protilátek
Přímé barvení: Někteří výzkumní pracovníci mohou ocenit pohodlí přístupu "přímého barvení", při kterém je primární protilátka přímo konjugována s fluoroforem, protože vazby a fluorescenční detekce je dosaženo v jediném kroku a celkový čas potřebný k dokončení protokolu IF-ICC se zkrátí.Přímé konjugáty také usnadňují multiplexní barvení více cílů ve stejném vzorku tím, že odpadá nutnost volit primární protilátky z různých hostitelů, aby se zabránilo zkřížené reaktivitě (více o multiplexní IF-ICC níže).
Pokud se používá konjugát primární protilátky, měl by se tento krok provádět ve tmě, aby byl fluorofor chráněn před fotoblením. Po inkubaci s primárním konjugátem může protokol okamžitě přejít k promytí a montáži. K obarvení více cílů ve vzorku v jednom kroku lze použít koktejl protilátek.
Metoda nepřímého barvení: Při "nepřímé" imunodetekci následuje po neznačené primární protilátce specifické pro cíl sekundární protilátka konjugovaná s fluoroforem, která detekuje hostitelský druh primární protilátky. Tato technika poskytuje výraznou výhodu zesílení signálu, protože existuje možnost, že se na primární protilátku naváže více sekundárních protilátek nesoucích fluorofor, čímž se zvýší počet molekul emitujících fluorescenci v místě antigenu.
Multiplexní cílení na více antigenů současně ve stejném vzorku vyžaduje u metody nepřímé detekce další úvahy, jak je vysvětleno níže.
Výběr protilátky: on-target, specifická reaktivita
Primární protilátka:
Při nepřímé detekci se protilátky použijí v koktejlu pro multiplexní experimenty, a to jak v primárním, tak v sekundárním inkubačním kroku. Proto je nezbytné zvolit pro každý cíl primární protilátky, které byly vypěstovány v jiném hostiteli. Tím se zajistí, že se každá konjugovaná protilátka v sekundárním koktejlu naváže na jedinečnou primární protilátku ve vzorku. Pokud pro každou cílovou protilátku nezvolíte jedinečné hostitele, budou výsledky barvení neinterpretovatelné. Níže je uveden příklad experimentálního uspořádání pro multiplexní nepřímou detekci:
| Cíl | Primární protilátka/reagencie | .Reaktivita sekundární protilátky | Sekundární protilátka emise | Vzorový fluorofor |
|---|---|---|---|---|
| A | Králičí anti-A | Králičí anti | zelená | FITC, CF488A |
| B | Myší anti-B | Myší anti | červený | Rhodamin, CF568 |
| C | Potkaní anti-C | Potkaní anti | Červený | Cy5, CF647 |
| jádro | DAPI nebo Hoechst | - | UV |
V tomto příkladu, pokud by výzkumník místo toho zvolil králičí primární protilátku anti-B, by byly anti-A i anti-B zaměřeny konjugátem proti králičímu sekundárnímu konjugátu a oba cíle A i B by byly označeny zeleným fluorescenčním signálem.
Křížová reaktivita primární protilátky a tkáně: Při výběru protilátek pro nepřímé barvení je vhodné zrušit výběr jakýchkoli primárních protilátek chovaných ve stejném hostiteli, z něhož pochází vzorek - například nepoužívejte myší primární protilátku na myší tkáň. Následné použití sekundární protilátky proti myši by pravděpodobně vedlo k rozsáhlé vazbě sekundární protilátky přímo na tkáň, což by způsobilo výrazné barvení na pozadí. Ačkoli se prodávají soupravy, které mají blokovat reaktivitu hostitel na sebe, nejrizikovějším postupem je vyhnout se reaktivitě hostitel na sebe při výběru primárních protilátek pro nepřímé protokoly. POZNÁMKA: zkřížená reaktivita hostitel na sebe není obecně problémem pro přímé barvení.
Sekundární protilátky:
Jak je vysvětleno výše (Výběr protilátek: technika barvení, nepřímá metoda, výše), "nepřímá" IF-ICC umožňuje zesílení signálu, protože více sekundárních protilátek může vázat primární protilátky vázané na cíl. Nepřímá IF-ICC však také umožňuje laboratoři vytvořit modulární knihovnu sekundárních protilátek která bude kompatibilní s rostoucí kolekcí primárních protilátek, takže jakýkoli cíl lze přiřadit k jakémukoli dostupnému filtrovacímu kanálu mikroskopu.
Vymývání:
Vymývání po každé aplikaci protilátky nebo jiné fluorescenční sondy eliminuje protilátky s nižší vazebnou afinitou přítomné ve vzorku, a tím snižuje nespecifický signál nebo zkříženou reaktivitu. Důležitost promývacího kroku nelze přeceňovat. Několikaminutové promývání v PBS s alespoň dvěma výměnami pufru pomůže odstranit nenavázané a volně vázané protilátky ze vzorku.
Delší promývání nemusí přinést znatelný přínos pro snížení pozadí, ale obecně není škodlivé, pokud delší doba v pufru neoddělí vzorek od sklíčka nebo krycího skla. Velmi krátké promývání s menším počtem opakování nemusí účinně odstranit protilátku, která není specificky vázána na cíl, což může vést ke špatnému poměru signálu k pozadí.
Jaderné protibarvení a upevnění:
Mnozí výzkumníci provádějící IF-ICC mohou chtít použít fluorescenční činidlo, které označuje buněčné jádro, například DAPI nebo Hoechst. Protože obě tato barviva interkalují a fluoreskují během několika sekund po přístupu k DNA, lze použít montážní médium obsahující DAPI k dosažení jaderného barvení a montáže v jediném kroku. To šetří čas tím, že odpadá nutnost oddělených kroků barvení DAPI/Hoechst a promývání, a snižuje variabilitu koncentrace a inkubační doby pro jaderné protibarvení.
Všechna montážní média pomáhají připevnit krycí sklíčko ke sklíčku a uchovat vzorek pro mikroskopování tím, že zabraňují dehydrataci. Mnohá montážní média mají také složení optimalizující index lomu pro mikroskopii a mohou obsahovat látky, které chrání fluorofory navázané na obarvený vzorek před fotoblením.
Experimentální kontroly pro IF-ICC
Stejně jako u jiných experimentů zvýší zařazení pozitivních a negativních kontrol důvěru v citlivost a specifičnost výsledků fluorescenční ICC.
Kontroly pro experimenty IF-ICC mohou zahrnovat:
Vynechání primární:
Jednoduchou kontrolou, kterou lze snadno zahrnout do jakéhokoli experimentu ICC, je kontrola, při níž je primární protilátka vynechána z kroku primárního barvení v protokolu nepřímé imunodetekce. Tím se prokáže, zda případný pozorovaný signál není způsoben nespecifickou vazbou fluorescenční sekundární protilátky přímo na vzorek.
Izotypová kontrola:
Při přímém barvení konjugovanými primárními protilátkami pomáhá vzorek, kde je izotypová kontrola konjugovaná se stejným fluoroforem nahrazena primárním konjugátem, zajistit, že případný pozorovaný signál je způsoben specifitou primární protilátky pro antigen. Izotypové kontroly jsou často k dispozici u dodavatele konjugátu protilátky a jsou stejné třídy a typu imunoglobulinu jako protilátka proti antigenu, ale nemají specifitu pro žádný známý epitop. Izotypy slouží jako kontrola primární protilátky, protože jejich zařazení prokazuje, že jakýkoli pozorovaný signál není způsoben pouhou "lepivostí" samotného proteinu primární protilátky.
Buňky negativní pro cílový antigen:
Může být známo, že určitý typ buněk neexprimuje antigen, který je předmětem zájmu, a může sloužit jako negativní kontrolní vzorek. Případně jsou buňky s cílovým antigenem geneticky modifikované tak, aby se cílový protein neexprimoval (knock-out buňky) spolehlivou kontrolou cílové specifity, pokud jsou k dispozici. Techniky genetické modifikace, jako je CRISPR/Cas nukleáza lze použít k vyřazení exprese cílového proteinu a vytvořit tak negativní kontrolní buněčnou linii.
Buňky pozitivní na cílový antigen:
Pokud jsou k dispozici buňky, u nichž bylo dříve prokázáno, že exprimují antigen, který je předmětem zájmu, ať už endogenně, nebo modifikací za účelem "knock in" nebo nadměrné exprese genu, mohou sloužit jako pozitivní kontrola k potvrzení, že barvicí protokol vytváří signál, když je ve vzorku přítomen cílový antigen.
Interní rady pro získání nejlepšího signálu - a překonání pozadí - pomocí IF-ICC
- Kdykoli je to možné, vybírejte protilátky, u kterých jsou k dispozici údaje prokazující výsledky v aplikacích ICC
- Přizpůsobte spektrální charakteristiky fluorescenčních protilátek laserům a filtrům mikroskopu
- Vybírejte vzorky buněk, které jsou zdravé, bez kontaminace a precipitátů a subkonfluentní
- Optimální způsob fixace a permeabilizace závisí na cíli a jeho subcelulárním umístění
- Zřeďte protilátky v blokovacím pufru, abyste zachovali blokování po celou dobu barvicího protokolu
- Přímá detekce pomocí fluorescenční sekundární protilátky umožňuje zesílení signálu
- Přímá detekce pomocí fluorescenční sekundární protilátky umožňuje zesílení signálu
- Při výběru z konjugátů protilátek s podobnými spektrálními charakteristikami zvolte stabilnější fluorofor, abyste se vyhnuli fotoblednutí při dlouhých nebo opakovaných expozicích mikroskopu - a předešli spektrálnímu překrývání
- Vždy zahrňte vhodné kontroly barvení. Použijte pozitivní a negativní biologické kontroly, pokud jsou k dispozici.
Network error: Failed to fetch
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?Toto je strojově přeložená stránka.