Inteligentní povrchy na bázi poly(N-isopropylakrylamidu) pro tkáňové inženýrství buněčných listů
Masamichi Nakayama1, Teruo Okano1, Françoise M. Winnik2
1Institute of Advanced Biomedical Engineering and Science, Tokyo Women′s Medical University (TWIns), Kawada-cho 8-1, Shinjuku, Tokyo 162-8666, Japan, 2Department of Chemistry and Faculty of Pharmacy, University of Montreal, CP 6128 Succursale Centre Ville, Montreal QC Canada H3C 3J7
Material Matters 2010, 5.3, 5
Úvod
Tkáňové inženýrství se stalo klíčovým terapeutickým nástrojem při léčbě poškozených nebo nemocných orgánů a tkání, jako jsou krevní cévy a močové měchýře.1 Přesto je stále třeba překonat velké výzvy, zejména konstrukci tkání s vysokou hustotou buněk a prevenci zánětu po transplantaci. Slibný přístup tkáňového inženýrství spočívá v použití povrchů buněčných kultur roubovaných poly(N-isopropylakrylamidem) (PNIPAM, prod. No. 535311).2 Základní myšlenka spočívá v tom, že adheze/odpojení buněk na substrátech modifikovaných PNIPAMem lze dosáhnout jednoduchým teplotním spínačem (obrázek 1).

Obrázek 1.(a) Schematické znázornění adheze (37 °C) a odtržení (20 °C) buňky na povrchu roubovaném poly(N-isopropylakrylamidem). Sběru buněk se dosáhne pouhým snížením teploty. (b) Mikrofotografie endoteliálních buněk na miskách potažených PNIPAMem při 37 °C a 20 °C. Všimněte si protáhlého tvaru buněk na levém mikrofotografickém snímku, který je charakteristický pro podloženou buněčnou kulturu, a zaobleného tvaru buněk vpravo, který je charakteristický pro volné buňky v roztoku.
Kultivované buňky lze z "chytrých" povrchů PNIPAM odebírat ve formě tkáňové buněčné monovrstvy nebo "buněčného listu" pouhým snížením teploty buněčné kultivace z 37 °C na 20 °C po dosažení konfluence. Tato technologie manipulace s buňkami umožňuje transplantaci buněčných vrstev do hostitelských tkání bez použití biodegradabilních polymerních scaffoldů, čímž se překonává hlavní omezení konvenčního tkáňového inženýrství. Chemie, která je základem tohoto procesu, je popsána v tomto článku, který začíná stručným přehledem vlastností PNIPAM ve vodném roztoku. Zvláštní důraz je kladen na návrh a výrobu modifikovaných povrchů používaných k získání multifunkčních buněčných fólií.
Poly(N-isopropylakrylamid): Všudypřítomný "chytrý" polymer
PNIPAM je rozpustný v organických rozpouštědlech, jako je chloroform, aceton, metanol a různé další alkoholy. Je také rozpustný ve vodě, pokud je roztok udržován v přiměřené teplotě. Zahřátím vodného roztoku PNIPAM nad 32 °C (bod zákalu (CP) nebo dolní kritická teplota roztoku (LCST)) se čirý roztok okamžitě změní na mléčnou suspenzi. Tento jev je vratný: jakmile se mléčná suspenze ochladí pod 32 °C, obnoví se její čirý vzhled.3 Koncem 60. let 20. století Heskins a Guillet publikovali první fázový diagram systému voda/ PNIPAM, který sestrojili na základě měření teploty fázového přechodu v závislosti na koncentraci PNIPAM.4 Přibližně ve stejné době vyšlo najevo, že zesíťované sítě PNIPAM (gely) vykazují ve vodě také zvláštní vlastnosti: ve studené vodě jsou silně nabobtnalé, ale jakmile se zahřejí nad 32 °C, smršťují se. Stejně jako v případě roztoků PNIPAM je chování gelů reverzibilní a nabobtnají zpět na původní objem, jakmile se ochladí pod 32 °C. Gel může provést stovky cyklů bobtnání a smršťování bez známek únavy materiálu. Tohoto neobvyklého jevu si všiml Allan S. Hoffmann, který jako jeden z prvních využil teplotou indukovaný fázový přechod derivátů PNIPAM jako spouštěč pro řízení jevů důležitých pro biomedicínské aplikace, jako je uvolňování barviva nebo léčiva.5 Tato průkopnická práce položila základy oboru responzivních systémů, který stále uchvacuje fantazii vědců.6 Teplem indukovaný fázový přechod, který vykazují vodné roztoky PNIPAM, není jedinečný, protože mnoho jiných polymerů rozpustných ve vodě má zákal. PNIPAM však zůstává lídrem pro biomedicínské aplikace díky ostrosti přechodu, teplotě přechodu, která se blíží teplotě těla, robustnosti samotného polymeru a dostupnosti informací o polymeru a jeho fázovém přechodu.
Na molekulární úrovni odpovídá makroskopický fázový přechod dehydrataci řetězců PNIPAM a následnému zhroucení denudovaných hydrofobních řetězců do kompaktních globulí, které se agregují do větších mezoglobulí (obrázek 2).7,8 Fázový přechod však nezávisí pouze na teplotou vyvolané molekulární přestavbě. CP PNIPAMu může ovlivnit několik dalších faktorů, i když jejich vliv není vždy předvídatelný.

Obrázek 2.Teplotně citlivé vlastnosti vodných roztoků poly(N-isopropylakrylamidu) (PNIPAM); a) při zahřátí nad LCST se hydratovaný prodloužený řetězec PNIPAM zhroutí do hydrofobní globule se současným uvolněním vázaných molekul vody; b) chemická struktura opakovací jednotky PNIPAM; c) graf změn propustnosti roztoku v závislosti na teplotě pro roztok PNIPAM ve vodě. LCST odpovídá středu přechodové křivky.
Molekulová hmotnost
O míře vlivu molekulové hmotnosti polymeru na bod zákalu se vedou diskuse. Některé zprávy uvádějí, že bod zákalu PNIPAM ve vodě přímo souvisí s molekulovou hmotností, jiné uvádějí inverzní závislost CP na molekulové hmotnosti a další uvádějí, že CP vodných roztoků PNIPAM je na molekulové hmotnosti nezávislá. Rozdíly jsou zvláště nápadné při porovnání výsledků získaných pro relativně krátké polymerní řetězce (Mw <20 000 g/l), u nichž má chemická povaha konce řetězce významný vliv na hodnotu CP.9 Polymery s hydrofilními koncovými skupinami mají tendenci vykazovat relativně vysoký bod zákalu v roztocích o nízké koncentraci, zatímco polymery s hydrofobními koncovými skupinami mají za stejných podmínek obvykle nižší CP.10 Tyto trendy se porušují u roztoků PNIPAM se silně hydrofobními koncovými skupinami, jako jsou n-oktadecylové řetězce, které se samy shromažďují ve vodě a vytvářejí květové a hvězdicové micely.11,12
Systémy rozpouštědel
Přítomnost systémů s více rozpouštědly může mít rovněž vliv na CP PNIPAM. Například při pokojové teplotě není PNIPAM rozpustný ve směsném roztoku vody a methanolu v celém rozsahu složení - projevuje se jev zvaný ko-rozpouštění.13
Přítomnost solí
Přítomnost solí může rovněž ovlivnit CP vodných roztoků PNIPAM, přičemž některé soli způsobují zvýšení CP, zatímco přídavek jiných solí přináší snížení CP. Pro tato pozorování bylo nabídnuto několik vysvětlení.14 Jakmile budou faktory ovlivňující fázový přechod PNIPAM plně pochopeny, bude možné je využít k přizpůsobení a optimalizaci PNIPAM pro další aplikace. Vzrušující využití tohoto chytrého polymeru však již bylo odhaleno.
Temperaturně citlivé misky pro buněčné kultivace pro inženýrství buněčných listů
Misku pro buněčné kultivace potaženou PNIPAMem připravíme ozářením elektronovým paprskem (0.3 MGy při 150 kV) monomeru NIPAM (724459), naneseného na komerční polystyrenové misky pro tkáňové kultury (TCPS) z roztoku NIPAM ve 2-propanolu (obrázek 3). Tato úprava vede k současné polymerizaci NIPAM a kovalentnímu roubování rostoucích polymerních řetězců na povrchy TCPS. Metoda je čistá, snadno se dá škálovat a vzorovat a umožňuje jemnou kontrolu nad tloušťkou polymerní vrstvy. Pro většinu aplikací pro buněčné kultury by se tloušťka roubované vrstvy PNIPAM měla pohybovat v rozmezí 15-20 nm, což odpovídá hustotě roubování 1,4-2,0 μg/cm2.15
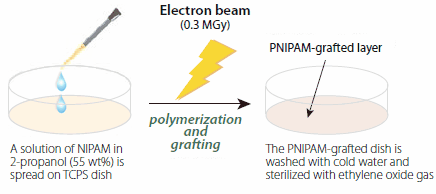
Obrázek 3.Schéma postupu přípravy poly(N-isopropylakrylamidem) roubovaných misek pro buněčné kultury.
Různé typy buněk přilnou a rostou na kultivačních površích PNIPAM reagujících na teplotu za kultivačních podmínek podobných těm, které se používají u běžných misek TCPS. Po dosažení konfluence buněk při 37 °C se misky ochladí pod 32 °C (obvykle na 20 °C). Polymerní řetězce se rehydratují a odpuzují buňky, což způsobí, že se buňky odlepí od kultivačního povrchu ve formě buněčného listu tvořeného souvislou monovrstvou buněk. V konvenčním tkáňovém inženýrství založeném na buňkách se do kultivačního média přidávají proteolytické enzymy (např. trypsin a dispáza), aby se buňky oddělily narušením adhezních molekul buněk a proteinů extracelulární matrix (ECM). Toto ošetření může také ovlivnit proteiny buněčné membrány, které jsou životně důležité pro charakteristické funkce různých typů buněk. Ke sklizni buněk kultivovaných na teplotně citlivých površích není nutné žádné enzymatické ošetření. Proto lze obnovené buněčné listy, které stále obsahují základní proteiny ECM, přenést na nové kultivační misky, jiné buněčné listy nebo živé tkáně. Probíhá několik klinických studií tkáňového inženýrství s využitím transplantace jednotlivých buněčných listů, například rohovky a parodontálního vazu. Probíhající studie zahrnují homo- a heterotypické vrstvení více buněčných listů za účelem vytvoření 3D architektury podobné tkáni, jako je srdeční nebo jaterní tkáň.16
Vzorované povrchy reagující na teplotu pro heterotypickou buněčnou ko-kulturu
Pro napodobení specifických funkcí tkání je nutné regenerovat prostorově uspořádané tkáňové architektury s heterotypickými interakcemi mezi buňkami. Není snadné integrovat více buněčných typů do jedné 3D tkáňové architektury, protože adhezivní a proliferační vlastnosti různých buněčných typů obvykle nejsou stejné. Ve většině případů se ko-kultivace různých buněčných typů provádí na površích s mikrotvarovkami. Teplotně citlivé povrchy s mikrotvarovkami lze snadno vyrobit na základě skutečnosti, že LCST PNIPAM lze modulovat také inkorporací komonomeru. Kopolymery NIPAM s hydrofilními komonomery mají LCST >32 °C, zatímco kopolymery NIPAM obsahující hydrofobní monomer, jako je n-butylmetakrylát (BMA), mají LCST <32 °C. Pro přípravu povrchu s mikrotiskem se roztok BMA (235865) ve 2-propanolu rozetře na misku TCPS roubovanou PNIPAM. Následně se povrch pokrytý BMA ozáří elektronovým svazkem přes mikroskopickou masku z nerezové oceli.17 Monomery BMA se v ozářených oblastech naroubují na předem vytvořenou vrstvu PNIPAMu, na rozdíl od maskovaných částí, kde je původní PNIPAM zachován. Teplota přechodu ozářených oblastí je nižší než 32 °C. Skutečná hodnota LCST je modulována řízením úrovně inkorporace BMA. Aplikace této metody vzorování pro společnou kultivaci hepatocytů (HC) a endoteliálních buněk (EC) je znázorněna na obrázku 4.
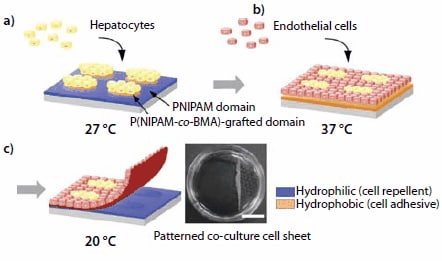
Obrázek 4.Schematické znázornění vzorové buněčné kultivace a sklizně kokultivovaného buněčného listu pomocí vzorovaného povrchu reagujícího na teplotu. (a) Hepatocyty (HCs) jsou nasazeny a kultivovány při teplotě 27 °C, což vede k lokalizaci HCs na ostrůvky s hydrofobní povahou, které jsou roubovány na P(NIPAM-co- BMA). (b) Endoteliální buňky (ECs) jsou nasazeny a kultivovány při 37 °C, čímž vznikají vzorované kokultury. (c) Snížení teploty na 20 °C vyvolá oddělení ko-kultivovaného buněčného listu. Sebraný vzorovaný kokulturovaný buněčný list (vpravo; měřítko: 1 cm).
Nejdříve se HCs nasadí na rozhraní s mikrotvarovkami, které se udržuje při teplotě 27 °C. Přilnou výhradně na domény P(NIPAM-co-BMA), které jsou při této teplotě dehydratované (hydrofobní). Domény PNIPAM, které jsou při 27 °C hydratované (hydrofilní), buňky odpuzují (obrázek 4a). Poté se rozhraní pokryté HC zahřeje na 37 °C. Domény PNIPAM se stanou hydrofobními a EC jsou nasazeny. Ty přilnou k doménám PNIPAM a množí se (obrázek 4b a 4c). Snížení teploty kultivace na 20 °C vyvolá hydrataci celého povrchu. Monovrstva ko-kultivovaných buněk se spontánně oddělí a vznikne souvislý buněčný list s heterotypickými buněčnými interakcemi. S obnovenými ko-kulturními buněčnými vrstvami lze manipulovat a vkládat je mezi jiné buněčné vrstvy pro přípravu vícevrstvých materiálů napodobujících tkáň.
Funkcionalizace teplotně citlivé kultivační misky
Chemicky reaktivní (funkční) komonomery mohou být začleněny do roubované vrstvy PNIPAM a sloužit jako místa pro zavedení bioaktivních molekul, jak je ukázáno na obrázku 5.15
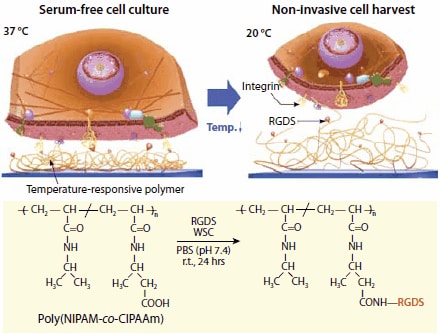
Obrázek 5.Schematické znázornění řízení afinity mezi integrinovými receptory a peptidy RGDS (Arg-Gly-Asp-Ser) v závislosti na teplotě. RGDS ligandy jsou konjugovány s P(NIPAM-co-CIPAAm) pomocí tvorby amidové vazby s N-(3-dimethylaminopropyl)- N′-ethylkarbodiimid hydrochloridem (ve vodě rozpustný karbodiimid (WSC, prod. č. E1769) jako spojovacím činidlem. Při teplotě 37 °C se polymer reagující na teplotu smršťuje a vystavuje ligandy RGDS (červené kuličky) integrinovým receptorům buněčné membrány (žluté). Buňky tak lze kultivovat v podmínkách bez použití séra na teplotně citlivých kultivačních miskách imobilizovaných RGDS. Snížením kultivační teploty na 20 °C lze buňky neinvazivně odebírat. Ligandy RGDS zůstávají navázány na povrch teplotně citlivého polymeru.
Nejprve jsou misky TCPS roubovány kopolymerem NIPAM a 2-karboxyisopropylakrylamidu (CIPAAm) polymerizací směsi NIPAM/CIPAAm elektronovým paprskem (obsah CIPAAm: 1-5 mol %). Následně se syntetický tetrapeptid pro buněčnou adhezi, Arg-Gly-Asp-Ser (RGDS, A9041), kovalentně naváže na misku TCPS roubovanou P(NIPAM-co- CIPAAm) pomocí standardních metod tvorby amidových vazeb.18 Přítomnost RGDS na rozhraní podporuje adhezi buněk a jejich růst do konfluence při 37 °C za podmínek kultivace bez séra doplněné rekombinantními růstovými faktory. Po dosažení konfluence lze buňky odebrat jako neporušené buněčné listy pouhým snížením teploty na 20 °C, stejně jako v případě kultivačních misek s PNIPAMem. Rehydratace povrchových řetězců PNIPAM nevratně naruší interakce mezi povrchově imobilizovanými peptidy RGDS a integrinovými receptory buněčné membrány. Tato strategie výrazně zkracuje dobu kultivace a umožňuje růst buněk bez tradičního fetálního hovězího séra, což je důležitý aspekt vzhledem k potenciálním rizikům spojeným s používáním produktů ze savčích zdrojů při výrobě tkání používaných v klinických aplikacích pro lidské buněčné terapie.
Závěr
Vyplývá to z výsledků studie, která byla provedena v roce 2007.Budoucí pokrok v oblasti inženýrství buněčných listů reagujících na teplotu závisí na dostupnosti přesně optimalizovaných povrchů roubovaných PNIPAM, které umožňují řízenou výrobu heterotypických buněčných listů. Jeden ze slibných přístupů spočívá v použití kartáčů PNIPAM s řízenou tloušťkou a hustotou roubování připravených řízenou radikálovou polymerizací, jako je polymerizace s přenosem atomu (ATRP) a reverzibilní polymerizace s přenosem adičního a fragmentačního řetězce (RAFT).19-21 Vývoj těchto nových inteligentních povrchů a jejich výzkumné a lékařské využití otevře nové hranice v biologické a lékařské oblasti.
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?