Polysacharidy značené FITC
FITC-Dextran
FITC-DEAE-dextran (FDD)
FITC-karboxymethyl-dextran (FCM-Dextran)
FITC-polysukróza (FITC-Ficoll®)
FITC-DEAE-polysukróza
FITC-DEAE-polysukróza
FITC-CM-polysukróza (FITC-CM-Ficoll®)
FITC-inulin
Fluoresceinová kyselina hyaluronová (FHA-Se)
TRITC-značené polysacharidy
TRITC-polysukróza (TRITC-Ficoll®)
Polysukróza (TRITC-Ficoll®)
Tetrametyl-rhodaminová kyselina hyaluronová (TR-HA)
Reference
FITC-Dextran
Fluorescein isothiokyanát dextran
Chemické názvy:
Dextran(3´,6´dihydroxy-3-oxospiro(isobenzofuran-1(3H),9´-[9H]xanthen]-5(nebo 6)-yl)karbamothioát.
Fluorescein isothiokyanát-dextran.
Fluoresceinyl thiokarbamoyl-dextran.
Číslo CAS: 60842-46-8
Struktura

Definice
Mw: Mn: DS: průměrná početní průměrná molekulová hmotnost
DS: Definuje počet substitučních molekul na jednu molekulu glykosy v polysacharidovém řetězci
Vlastnosti
Vybrané frakce dextranu připravené z nativního dextranu B512F jsou značené fluoresceinem pomocí stabilní thiokarbamoylové vazby - postup značení nevede k žádné depolymerizaci dextranu1. DS FITC-dextranů se pohybuje v rozmezí 0,002-0,008 a při těchto nízkých úrovních substituce propůjčuje dextranům minimální náboje, což je důležité pro studie propustnosti.
FITC-dextran se dodává jako žlutooranžový prášek, který se volně rozpouští ve vodě nebo v roztocích solí a vytváří žlutý roztok. Produkt se také rozpouští v DMSO, formamidu a některých dalších polárních organických rozpouštědlech, ale je nerozpustný v nižších alifatických alkoholech, acetonu, chloroformu, dimethylformamidu. Frakce s vysokou molekulovou hmotností by se měly rozpouštět pomalým přidáváním prášku do teplé vody (přibližně 60 °C) za intenzivního míchání.
Molekula dextranu s molekulovou hmotností vyšší než 5 000 daltonů se v roztoku chová jako pružná a protáhlá spirála. Tabulka 1 ukazuje molekulové rozměry při různých molekulových hmotnostech. Dextrany a FITC-dextrany vykazují newtonovské tokové charakteristiky, tj. viskozita nezávisí na smykové rychlosti.
Spektrální data
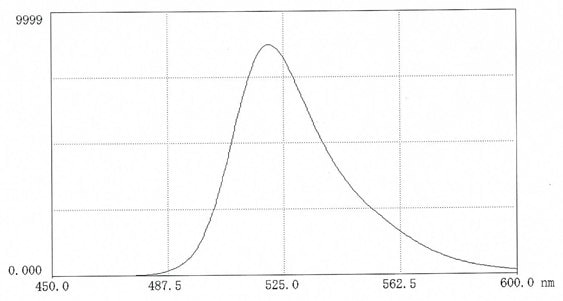
Obrázek 1.Fluorescenční skenování FITC-dextranu 70 v 0,025M boritanu pH 9,0 ( 10 mg v 50 ml pufru). Excitace 495 nm; emise 520 nm.

Obrázek 2.Fluorescence (emise 520 nm) FITC-dextranu v rozmezí pH 4-9
Skladování a stabilita
Stabilita FITC-dextranů in vitro a v případech, kdy je FITC-dextran v přípravku FITCin vivo je vynikající - pouze při zvýšeném pH(>9) a zvýšených teplotách hrozí hydrolýza fluoresceinové značky. Studie při teplotě 37 °C
v králičí plazmě, svalovém homogenátu, jaterním homogenátu a moči prokázaly, že FITC-dextrany jsou stabilní po dobu nejméně 3 dnů2. Nebyly zaznamenány žádné změny Mw. ani uvolňování fluoresceinových částí. FITC-dextran je stabilní v 6% kyselině trichloroctové při pokojové teplotě po dobu 3 dnů2. Autoklávované roztoky FITC-dextranu 70 byly skladovány při teplotách od 8 do 50 °C po dobu až 5 měsíců. Pouze vzorky skladované při 50 °C vykazovaly mírný nárůst (1 %) volného aminofluoresceinu. Bylo zjištěno, že FITC-dextran je stabilní při pH 4, ale při pH 9 došlo při teplotě 35 °C během 1 měsíce ke značnému (24%) poklesu fluorescence. Několik studií3 potvrdilo in vivo stabilitu FITC-dextranů během pokusů (1-6 dní) .
Použití
FITC-dextrany se používají především ke studiu propustnosti a transportu v buňkách a tkáních, ale lze je použít i ke studiu propustnosti jiných materiálů (filtrů, gelů atd.). Zvláštní výhodou je, že měření fluorescence poskytuje kvantitativní údaje o propustnosti zdravých a nemocných tkání v reálném čase. Intravitální fluorescenční mikroskopie nabízí vysokou citlivost a ve tkáňových tekutinách lze detekovat koncentrace až 1 μg/ml. Bylo vyvinuto několik modelů pro usnadnění studií v reálném čase4,5 FITC-dextrany byly také použity jako pH sonda v buňkách6,7. Z polarizačních experimentů bylo také zjištěno, že doba života excitovaného stavu je podobná době života před konjugací .
FITC-dextrany se ukázaly jako cenné v následujících oblastech studia (odkazy vybrané z rozsáhlého seznamu k jednotlivým tématům):
- Studie propustnosti střevních tkání8-10
- Studie propustnosti mozku a nervového systému11-13
- Studie propustnosti nádorových tkání14-16
- Studie propustnosti v oční komoře17-19
- Studie propustnosti tkání ledvin20

Obrázek 3.Snímky pořízené z lícního vaku po infuzi FITC-dextranu 150. Druhý snímek ukazuje prosakování mikrovaskulatury po působení histaminu. (foto se svolením E. Svensjö).

Vlastnosti
FITC-DEAE-dextrany se dodávají ve formě žlutého prášku, který je volně rozpustný ve vodě nebo roztocích elektrolytů. Rychlost rozpouštění závisí na velikosti a struktuře částic a doporučuje se prášek přidávat pomalu za intenzivního míchání - u vysokomolekulárních produktů lze vodu zahřát. DS(FITC) se pohybuje v rozmezí 0,001 - 0,008 a mezní hodnoty obsahu dusíku jsou 3 - 5 % - což odpovídá přibližně jednomu DEAE-substituentu na tři glukózové jednotky. Syntéza zavádí do dextranového řetězce dva typy DEAE-substituentů (viz struktura výše). Převládajícím substituentem je jedna terciární skupina, která však dále reaguje zejména při vyšších DS za vzniku "tandemové" skupiny obsahující kromě terciárního aminu také kvartérní amin.
Spektrální údaje

Obrázek. 4.Fluorescenční skenování FITC-DEAE-dextranu v 0,025M boritanu pH 9,0 (10 mg v 50 ml pufru). Excitace 495 nm; emise 520 nm.
Skladování a stabilita
Prášek je stabilní při pokojové teplotě po dobu delší než tři roky, pokud je skladován v dobře uzavřených nádobách ve tmě. V roztoku by FITC-DEAE-dextran neměl být delší dobu skladován při pH>8.
Použití
FITC-DEAE-dextran bude mít mnoho vlastností, které vykazují mateřské DEAE-dextrany, ale bude také vykazovat fluorescenci, aby bylo možné jej sledovat. Některé aplikace DEAE-dextranů jsou uvedeny níže:-
- Jako adjuvans pro vakcíny
- Zlepšuje vychytávání bílkovin a nukleových kyselin buňkami - transfekční techniky a virová infekčnost
- Pro stabilizaci proteinů (enzymů)
FITC-DEAE-dextrany byly použity ke studiu doručování kladně nabitých molekul do jaderných buněk prostřednictvím perforinového póru21. Ve studii promotorů absorpce22 byla porovnávána propustnost FITC-DEAE-dextranů, FITC-dextranu a FITC-dextran sulfátu nosní sliznicí.
FITC-karboxymethyl-dextran (FCM-Dextran)
Chemické názvy:
FITC-karboxymethyl-dextran
Fluorescein-thiokarbamoyl-(O-karboxymethyl)-dextran
Číslo CAS; není k dispozici
Struktura

Vlastnosti
FITC-CM-dextrany se vyrábějí reakcí vybraných frakcí dextranu s aktivovaným karboxymethylderivátem v alkáliích, přičemž O-karboxymethylové skupiny se zavádějí podél řetězce dextranu. Obsah karboxylu je přibližně 5 %, což odpovídá přibližně jedné CM skupině na každých pět glukosových jednotek. Poté se reakcí s fluorescein isothiokyanátem zavedou fluoresceinové skupiny. DS(FITC) se pohybuje mezi 0,003 a 0,008. FITC-CM-dextrany se dodávají jako žlutý prášek, který je volně rozpustný ve vodě nebo v roztocích elektrolytů. Produkty mají výrazný polyaniontový charakter díky připojeným záporně nabitým karboxylovým skupinám. Očekává se, že vlastnosti roztoku FITC-CM-dextranů budou srovnatelné s vlastnostmi CM-dextranů23-25. V neutrálních roztocích se karboxymethyl substituenty vzájemně odpuzují, což vede k expanzi dextranové spirály. FITC-CM-dextrany jsou nerozpustné ve většině organických rozpouštědel, například v ethanolu, methanolu, acetonu, chloroformu, ethylacetátu.
Spektrální údaje

Obrázek. 5.Fluorescenční skenování FITC-CM-dextranu v 0,025M boritanu pH 9,0 (10 mg v 50 ml pufru). Excitace 493 nm; emise 519 nm.
Skladování a stabilita
Prospektivní studie stability prokázaly, že CM-dextrany si zachovávají svou účinnost a čistotu po dobu nejméně 3 let (nepublikované studie), a na základě našich zkušeností s FITC-dextrany předpokládáme podobnou stabilitu i u FITC-CM-dextranů. Doporučuje se skladovat FITC-CM-dextrany ve vzduchotěsných obalech ve tmě při pokojové teplotě.
Použití
Zjistilo se, že samotný CM-dextran je biokompatibilní a používá se jako výchozí materiál v několika farmaceutických a diagnostických aplikacích. Stejně tak se předpokládá, že toxicita FITC-CM-dextranu je rovněž nízká. Vložení karboxylové skupiny do dextranového řetězce poskytuje další možnosti imobilizace molekul se zajímavou biologickou aktivitou (léčiva, enzymy, diagnostické stopovací látky) na dextran. karboxylovou část lze použít v mnoha reakcích, například esterifikaci, amidaci s aminy, UGI nebo Passeriniho reakcích. Jednoduché iontově vazebné reakce mohou také poskytnout řadu derivátů zahrnujících různé kationtové molekuly26,27. Karboxylové skupiny také dodají molekule celkový záporný náboj, což může být cenné pro získání informací o vlastnostech propustnosti buněčných membrán a tkání28. Bylo zaznamenáno použití FITC-CM-dextranu při studiu systémů pro podávání léčiv29.
FITC-Polysucrose (FITC-Ficoll®)
Chemical Names:
Polysukróza(3´,6´dihydroxy-3-oxospiro(isobenzofuran -1(3H),9´-[9H]xanthen]-5
(nebo 6)-yl)karbamothioát.br> Fluorescein isothiokyanát-polysukróza
Číslo CAS; není k dispozici
Struktura:

Vlastnosti
Frakce polysacharidů se značí fluoresceinem postupem podobným tomu, který popsali de Belder a Granath1. Fluoresceinová část je připojena stabilní thiokarbamoylovou vazbou a postup značení nevede k žádné depolymeraci polysukrosy. DS FITC-polysukrosy se pohybuje v rozmezí 0,001- 0,008 a při těchto nízkých hladinách substituce propůjčuje polysukrose minimální náboje.
FITC-polysukrose se dodává jako žlutý prášek, který se volně rozpouští ve vodě nebo v roztocích solí za vzniku žlutého roztoku. Produkt se také rozpouští v DMSO, formamidu a některých dalších polárních organických rozpouštědlech, ale je nerozpustný v nižších alifatických alkoholech, acetonu, chloroformu a dimethylformamidu.
Molekula polysukrosy se v roztoku chová jako kulovitá molekula, což lze očekávat z její struktury. Srovnání Stokesova poloměru frakcí dextranu a polysukrosy odráží tyto rozdíly v molekulární flexibilitě (tabulka 2). Molekulu lze nejlépe považovat za mezistupeň mezi tvrdou pevnou koulí a pružnou spirálou. Proto při porovnávání polysukrosových a dextranových frakcí s podobnou molekulovou hmotností budou molekulové rozměry polysukrosy vždy menší. Roztoky polysacharózy mají velmi nízký osmotický tlak ve srovnání s roztoky sacharózy o stejné koncentraci. Tak má 10% roztok polysukrosy 70 osmolalitu 3 mOs/kg ve srovnání se 150 pro 10% sacharózu.
Nebyly publikovány žádné podrobné studie toxicity FITC-polysukrosy. Frakce polysukrózy (100 000 až 500 000) však při intravenózním podání v dávkách až 12 g/kg u pokusných zvířat nevykazovaly žádné toxické příznaky. Polysukróza vykazuje vynikající biokompatibilitu s buňkami, viry, mikroorganismy atd. a již po mnoho desetiletí se používá v technologii separace buněk.
Spektrální data

Obrázek 6.Fluorescenční skenování FITC-polysukrózy70 v 0,025M boritanu pH 9,0 (9,9 mg v 50 ml pufru). Excitace 496 nm; emise 525 nm. Měření v biologických médiích může významně ovlivnit intenzitu fluorescence, která může být zvýšená nebo snížená.
Skladování a stabilita
Prášek polysacharidu FITC je při skladování ve vzduchotěsných obalech při teplotě okolí stabilní nejméně 6 let. Stabilita FITC-polysukrosy v roztoku nebyla podrobně zkoumána. Nicméně stabilita thiokarbamoylové vazby mezi fluoresceinovou částí a polysukrózou bude podobná jako u dextranu (viz FITC-dextran). FITC-dextran je stabilní při pH 4 po dobu až 1 měsíce při teplotách do 35 °C, ale to nelze doporučit pro výrobky na bázi polysukrosy vzhledem k labilitě glykosidických vazeb v sacharóze. Polysukrózu samotnou lze autoklávovat při neutrálním a mírně alkalickém pH.
Použití
Dostupné údaje o dvou polysacharidech, polysukrose (Ficoll®) a dextranu, pro hodnocení glomerulární permselektivity ve srovnání s glomerulárními proteiny byly přezkoumány30. Polydisperzní polysacharidy jsou vynikajícími sondami pro měření glomerulární permselektivity a jsou reprodukovatelné, spolehlivé a elegantní. Autoři se podrobně zabývají různými vlastnostmi, které mohou ovlivnit výsledky, jako je velikost molekul, tvar, náboj a flexibilita, a hodnotí jejich výsledek v různých modelech pórů. Studie glomerulární permeability ficollu při intravenózní infuzi ukázaly, že má mezní hodnotu přibližně 50Å, zatímco dextran se vylučuje až do 60-70Å - to se vysvětluje větší flexibilitou dextranu. Clearance FITC-polysukrosy u myší, kterým chybí endoteliální kavely, byla studována za účelem objasnění makromolekulárních transportních cest31. Glomerulární filtr byl studován při různých rychlostech glomerulární filtrace pomocí FITC-polysukrózy 70 a 400 (také FITC-inulinu)32.
Studie glomerulární filtrace dextranu a ficollu ukázaly, že glomerulární membrána představuje mnohem restriktivnější bariéru pro ficoll než pro dextran33 . Zajímavé je, že hodnoty koeficientu sítování pro Ficoll se blížily hodnotám uváděným pro nenabité globulární proteiny. Glomerulární sítování u potkanů po operaci a svalovém traumatu bylo sledováno pomocí FITC-polysukrózy 70/40034. Potkanům byla podána směs FITC-polysukrózy 400 (960 μg), FITC-polysukrózy 70 (40 μg) a FITC-inulinu (500 μg) jako priming bolus. Glomerulární permeabilita byla studována u myší s knockoutem kaveolinu-1 pomocí FITC-polysukrózy 70/40035.
FITC-polysukróza 70 a albumin byly infundovány potkanům za účelem zkoumání vlivu teploty a chloridu amonného na frakční clearance. Polysukróza se chová jinak než dextrany a její clearance byla nižší v rozmezí 20-70 Å36,37. FITC-polysukróza 70 byla použita k posouzení, zda zvýšení clearance nativního albuminu po 9 týdnech diabetu bylo způsobeno sníženou nábojovou selektivitou nebo změnou podílu velkých pórů38.
FITC-DEAE-Polysucrose
Chemické názvy:
FITC-(O-diethylaminoethyl)-polysukrose
Fluoresceinyl-thiocarbamoyl-(O-diethylaminoethyl)-polysukrose
FITC-(O-diethylaminoethyl)-polysukrose
/p>
Číslo CAS; není k dispozici
Struktura:

Vlastnosti
FITC- DEAE-polysukróza se dodává jako žlutý prášek, který je snadno rozpustný ve vodě nebo pufrovacích roztocích a na každých pět hexosových skupin připadá přibližně jedna skupina DEAE. Limity pro stupeň substituce FITC jsou 0,001 až 0,008. Produkt má polykationtový charakter. Jak je znázorněno na výše uvedeném strukturním znázornění, DEAE-substituenty mohou být přítomny buď jako jedna jednotka, nebo jako "tandemová" jednotka - ta druhá obsahuje kvartérní amoniovou strukturu.
Spektrální údaje
Excitace se nejlépe provádí při 493 nm a fluorescence se měří při 523 nm (obrázek 7). Měření v biologických médiích může výrazně ovlivnit intenzitu fluorescence, která může být zvýšena nebo snížena.

Obrázek 7.Fluorescenční skenování FITC-DEAE-polysukrózy 70 v 0,025M boritanu pH 9,0 (10 mg v 50 ml pufru). Excitace 496 nm; emise 530 nm. Měření v biologických médiích může významně ovlivnit intenzitu fluorescence, která může být zvýšená nebo snížená.
Skladování a stabilita
FITC-DEAE-polysukróza se dodává jako suchý žlutý prášek a měla by se skladovat v dobře uzavřených nádobách při pokojové teplotě ve tmě. pH produktu při dodání je 6,5 - 7,0 a nemělo by klesnout pod pH 5. Produkt by neměl být skladován při pH > 7,0 po delší dobu.
Použití
Produkt se používá ke studiu propustnosti polykationtových polymerů ve vztahu k neutrálním polymerům v orgánech, tkáních a buňkách.
FITC-CM-Polysucrose (FITC-CM-Ficoll®)
Chemical Names:
FITC-(O-karboxymethyl)-polysucrose
Fluoresceinyl-thiokarbamoyl-(O-karboxymethyl)-polysucrose
Číslo CAS; není k dispozici
Struktura: FITC-(O-karboxymethyl)-polysucrose (FITC-(O-karboxymethyl)-polysucrose):

Struktura FITC-CM-polysukrózy
Spektrální data
Excitace se nejlépe provádí při 495 nm a fluorescence se měří při 517 nm (obrázek 8). Měření v biologických médiích může významně ovlivnit intenzitu fluorescence, která může být zvýšená nebo snížená. ZKONTROLUJTE

Obrázek 8.Fluorescenční skenování FITC-CM-polysukrózy 70 v 0,025M boritanu pH 9,0 ( 11 mg v 50 ml pufru). Excitace 495 nm; emise 517 nm.
Skladování a stabilita
FITC-CM-polysukróza se dodává jako suchý žlutý prášek a měl by se skladovat v dobře uzavřených nádobách při pokojové teplotě ve tmě. Roztoky lze uchovávat při pokojové teplotě nebo nejlépe v chladničce ve tmě při pH 6-7 po dobu několika týdnů.
Použití
FITC-CM-polysukróza sehrála zajímavou roli při objasňování vlastností glomerulární membrány a ukazuje se, že navzdory negativnímu charakteru membrány je permselektivita aniontových derivátů Ficollu větší než neutrálních druhů28. Pozdější studie s použitím FITC-CM-polysukrózy však tato zjištění vyvrátily39. Významná role náboje rozpuštěné látky v sítovém charakteru glomerulární membrány byla znovu zkoumána40.
<.a name="12" id="12">FITC-Inulin
Chemické názvy:
Inulin(3',6'dihydroxy-3-oxospiro(isobenzofuran-1(3H),9'-[9H]xanthen]-5(nebo 6)-yl)karbamothioát
Fluorescein isothiokyanát-inulin
Číslo CAS; není k dispozici
Struktura:

Vlastnosti
Frakce inulinu získaná z hlíz jiřinek je značena fluoresceinem postupem podobným tomu, který popsali de Belder a Granath1. Fluoresceinová část je připojena stabilní thiokarbamoylovou vazbou a postup značení nevede k žádné depolymeraci inulinu. DS FITC-inulinu se pohybuje v rozmezí 0,001-0,008 a při těchto nízkých hladinách substituce je vliv nábojů minimální.
FITC-inulin se dodává jako žlutý prášek, který se rozpouští ve vodě nebo roztoku soli za vzniku žlutého roztoku. Zředěné roztoky (1 - 2 %) zůstávají při stání čiré, ale koncentrovanější ( 10 %) mohou při stání tvořit sraženiny, protože inulin má tendenci vytvářet krystalické agregáty. Tyto sraženiny se při zahřátí znovu rozpustí. Teploty do 80 °C mohou být použity za předpokladu, že roztok má přibližně neutrální pH. Produkt se také rozpouští v DMSO, formamidu a některých dalších polárních organických rozpouštědlech, ale je nerozpustný v nižších alifatických alkoholech, acetonu, chloroformu, dimethylformamidu a ethylacetátu.
Mw FITC-inulinu stanovená metodou SEC (Superose 6 + 12; kalibrace dextranem) je přibližně 5 000 Mw. Phelps40 stanovil Mw inulinových frakcí z údajů o osmotickém tlaku a získal hodnotu 5640.
Spektrální údaje
Excitace se nejlépe provádí při 490 nm a fluorescence se měří při 520 nm (obrázek 9). Měření v biologických médiích může výrazně ovlivnit intenzitu fluorescence, která může být zvýšena nebo snížena. Závislost fluorescence na pH je znázorněna na obrázku 10.

Obrázek 9.Fluorescenční skenování FITC-inulinu v 0,025M boritanu pH 9,0 (10 mg v 50 ml pufru). Excitace 492 nm; emise 519 nm.

Skladování a stabilita
Stabilita thiokarbamoylové vazby mezi fluoresceinovou částí a inulinem bude podobná jako u dextranu (informace o stabilitě FITC-dextranu viz datový soubor). Neexistují žádné prospektivní studie stability FITC-inulinu, ale retrospektivní studie ukázaly, že prášek FITC-inulinu je při skladování ve vzduchotěsných obalech při pokojové teplotě stabilní po dobu nejméně 6 let. Roztoky FITC-inulinu by neměly být skladovány při pH(< 5) nebo vysokém pH(> 9) po delší dobu, zejména při zvýšených teplotách.
Použití
Ukázalo se, že FITC-inulin je ideální pro studium rychlosti glomerulární filtrace u pokusných zvířat, protože je stabilní během filtrace a průchodu ledvinami a neváže se na plazmatické bílkoviny ani neproniká do ledvinových buněk. Měření fluorescence poskytuje kvantitativní údaje o transportu a propustnosti zdravých a nemocných tkání. Tyto studie lze provádět v reálném čase pomocí intravitální fluorescenční mikroskopie. Tato technika nabízí vysokou citlivost a ve tkáňových tekutinách lze detekovat koncentrace až do 1 µg/ml.
Poměr koncentrace v tubulární tekutině a plazmě byl stanoven u potkanů po bolusové injekci FITC-inulinu do femorální žíly41. Platnost metody jako míry glomerulární filtrace byla stanovena srovnáním s 51Cr-EDTA a [H3]-inulinem.
Důkladné zkoumání použití FITC-inulinu pro studie GFR prezentoval Fleck v roce 199942. Potkanům byly podávány 4 mg/ml rychlostí 4 ml/100 g tělesné hmotnosti za hodinu přes ocasní žílu nebo krční žílu. Dunn a spolupracovníci43 zjistili vynikající korelaci mezi clearance kreatininu a clearance FITC-inulinu u myší. Byly popsány i další studie využívající FITC-inulin ke stanovení glomerulární filtrace44,45.
FITC-inulin byl použit ke studiu propustnosti střevních epiteliálních buněk46,47.
Fluorescein Hyaluronic Acid (FHA-Se)
Chemical Names:
5-aminofluoresceinem značený hyaluronan
5-aminofluoresceinem značený hyaluronan
Číslo CAS; není k dispozici
Struktura:

Vlastnosti
Kyselina hyaluronová, polysacharid složený ze střídajících se β(1-3) glukuronidů a β(1-4) glukosaminidových jednotek -získaných ze Streptococcus equi, se značí 5-amino-fluoresceinem za vzniku žlutého vláknitého produktu, který je rozpustný ve vodě a elektrolytech, avšak pevná látka vyžaduje dlouhodobé jemné míchání - přes noc - aby se rozpustila48. Stupeň substituce se pohybuje mezi 0,001 a 0,008. Molekulová hmotnost stanovená pomocí systému GPC, kalibrovaného pomocí standardů dextranu, poskytla Mw 6,0 x 106
Spektrální údaje
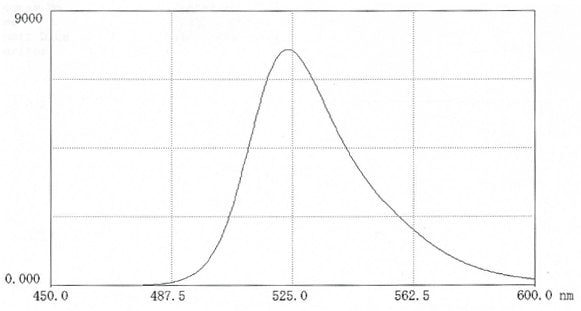
Obrázek 11.Fluorescenční skenování kyseliny FITC-hyaluronové v 0,025M boritanu pH 9,0 (12 mg v 50 ml pufru). Excitace 495 nm; emise 524 nm.
Skladování a stabilita
Sušený přípravek by měl být skladován ve vzduchotěsných obalech při pokojové teplotě ve tmě. Navrhuje se doba použitelnosti 5 let. Při inkubaci roztoku přípravku při pH 7,5 a teplotě 37 °C po dobu jednoho měsíce nebylo zaznamenáno žádné uvolňování fluorescenčního materiálu48.
Použití
V posledních letech se objevilo mnoho aplikací hyaluronanu jak v medicíně(zejména jeho nezastupitelný přínos v oční chirurgii), tak v kosmetice. Kyselinu hyaluronovou značenou fluoresceinem lze použít jako sondu pro sledování osudu hyaluronanu in vitro. Přípravek hyaluronové kyseliny značený FITC výrazně zlepšil vizualizaci prostupu substrátu kůží49. Objevily se další aplikace kyseliny hyaluronové značené fluoresceinem50-53
Polysacharidy značené TRITC
TRITC-Dextran
Chemické názvy:
Tetramethyl-rhodamin isothiokyanát-dextran
Dextran 3´, 6´bis(tetramethylamino)-3-oxospiro(isobenzofuran-1(3H),9´-9H]xanthen]-5(nebo 6)-yl)karbamothioát.
Tetramethyl-rhodamin B thiokarbamoyl-dextran
Číslo CAS; není k dispozici
Struktura:

Vlastnosti
TRITC-dextrany se připravují z vybraných frakcí dextranů spojením s izothiokyanátem tetrametylrhodaminu B (smíšené izomery). DS( TRITC) se pohybuje od 0,001 do 0,008. Při těchto nízkých stupních substituce je příspěvek náboje terciárních aminoskupin na rhodaminové části zanedbatelný. U všech šarží se kontroluje molekulová hmotnost, ztráta sušením a volný TRITC.
Spektrální údaje
Excitace se nejlépe provádí při 550 nm a fluorescence se měří při 572 nm (obrázek 12). Studie v našich laboratořích ukázaly, že fluorescence z roztoku TRITC-dextranu vykazuje pouze malé změny v rozmezí pH 3-9 (obrázek 13). To je zajímavé při provádění kvantitativních měření. Měření v biologických médiích může výrazně ovlivnit intenzitu fluorescence, která může být zvýšena nebo snížena.

Obrázek 12. Fluorescenční sken TRITC-dextranu 40 v 0,025M boritanu pH 9,0 (10 mg v 50 ml pufru) Excitace 550 nm; Emise 572 nm.

Obrázek 13.Závislost intenzity fluorescence (em. 572 nm) TRITC-dextranu na pH.
Skladovatelnost a stabilita
Stabilita TRITC-dextranů nebyla podrobně zkoumána, ale předpokládá se, že je podobná stabilitě FITC-dextranů, protože v obou případech jsou substituenty vázány přes thiokarbamoylovou jednotku. Pouze při zvýšeném pH (>9) a zvýšené teplotě existuje riziko hydrolýzy thiokarbamoylové vazby (viz FITC-dextran). Roztoky TRITC-dextranu (pH 6-7) lze skladovat při pokojové teplotě ve tmě po dobu několika týdnů. Suchý prášek při skladování v dobře uzavřených nádobách ve tmě má trvanlivost 5 let.
Použití
TRITC-dextrany se používají především ke studiu propustnosti a transportu v buňkách, cévách a tkáních. Měření fluorescence lze provádět kvantitativně a v reálném čase pomocí intravitální fluorescenční mikroskopie. Tato technika nabízí vysokou citlivost a ve tkáňových tekutinách lze detekovat koncentrace až do 1 μg/ml. Další důležitou vlastností je, že TRITC-dextran se neváže na stěny tepen54,55.
Mikrovaskulatura křeččího lícního vaku se ukázala jako užitečný model pro studium úniku plazmy v důsledku různých zánětlivých stavů. Lícní váčky se zkoumají intravitální fluorescenční mikroskopií s použitím vhodného filtru (490/520 nm) a snímky se pořizují digitální kamerou (obrázek 14). Podává se i.v. 5% roztok TRITC-dextranu 150 ve fyziologickém roztoku (přibližně 100 mg/kg tělesné hmotnosti)56-58. Více informací o těchto technikách naleznete v článku Thorball3. TRITC-dextrany byly hojně používány pro studie propustnosti ve tkáních a buňkách a uvádíme pouze několik namátkou vybraných odkazů59-65.

Obrázek 14.TRITC-dextran 150 vstříknutý do lícní kosti křečka 15 minut po podání histaminu. (s laskavým svolením E.Svensjö).

Vlastnosti
TRITC-polysukróza je derivát polysukrózy - polymeru syntetizovaného zesíťováním sacharózy epichlorhydrinem. TRITC-polysukróza se připravuje reakcí polysukrózy s TRITC za podobných podmínek, jaké se používají pro TRITC-dextrany. TRITC-polysukróza je snadno rozpustná ve vodě a v roztocích solí v širokém rozmezí pH. Polysukróza je citlivější na kyseliny než dextran, takže při práci s kyselým pH je třeba dbát zvýšené opatrnosti. Dodává se jako červený prášek, který je volně rozpustný ve vodě.
Spektrální údaje

Obrázek 15.Fluorescenční sken TRITC-polysukrózy 70 v 0,025M boritanu pH 9,0 (11 mg v 50 ml pufru) Excitace 522 nm; Emise 552 nm.
Skladování a stabilita
TRITC-polysacharidový prášek je při skladování ve vzduchotěsných obalech při pokojové teplotě stabilní po dobu nejméně 6 let. Stabilita TRITC-polysukrosy v roztoku nebyla podrobně zkoumána. Stabilita thiokarbamoylové vazby mezi tetramethylrhodaminovou částí a polysukrosou bude podobná jako u dextranu (TRITC-dextran). Skladování při nízkém pH se však pro výrobky na bázi polysukrosy nedoporučuje vzhledem k labilitě glykosidických vazeb v sacharóze. Samotnou polysukrózu lze autoklávovat při neutrálním a mírně alkalickém pH.
Použití
Polysukróza s obsahem TRITC má podobné použití, jaké bylo popsáno u polysukrózy s obsahem FITC, má však určité výhody. Jak již bylo zmíněno, fluorescence tetramethylrhodaminu je méně závislá na pH než u značek FITC. Také delší vlnová délka emise zabraňuje interferenci pozadí v experimentálním prostředí.
TRITC-polysukróza 70 byla použita při studiu endoteliální bariéry ledvin66,67. Studie protilátkové odpovědi na antigeny nezávislé na thymu byly prováděny pomocí TRITC-fikolů68.
Kyselina tetrametyl-rhodaminová hyaluronová (TR-HA)
Chemické názvy:
Kyselina tetramethyl-rhodaminová hyaluronová
Hyaluronan, 6´bis(tetramethylamino)-3-oxospiro(isobenzofuran-1(3H),9´-9H]xanthen]-5(nebo 6)-yl).
Hyaluronan s tetramethyl-rhodaminem B
Číslo CAS; není k dispozici
Struktura:
.
Vlastnosti
Kyselina hyaluronová, polysacharid složený ze střídajících se β(1-3) glukuronidových a β(1-4) glukosaminidových jednotek, pocházející ze Streptococcus equi, je značena aminotetrametylrhodaminem, čímž vzniká červený produkt rozpustný ve vodě a elektrolytech. DS se pohybuje mezi 0,001 a 0,008. Mw stanovená pomocí systému GPC, kalibrovaného pomocí standardů dextranu, poskytla hodnotu 6,0 x 106.
Spektrální údaje

Obrázek 16.Fluorescenční sken TR-HA v 0,025M boritanu pH 9,0 (12 mg v 50 ml pufru) Excitace 552 nm; Emise 576 nm.
Použití
Kyselina tetrametyl-rhodaminová hyaluronová (TR-HA) má podobné použití jako kyselina fluoresceinová hyaluronová (viz předchozí část), ale má určité výhody. Jak již bylo zmíněno, fluorescence tetramethylrhodaminu je méně závislá na pH než u značek FITC. Také delší emisní vlnová délka zabraňuje interferenci obrazů pozadí v experimentálním prostředí. Byl popsán invazivní růst do mozkové tkáně s využitím TR-HA a dvoufotonového zobrazování69.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?