N-連鎖糖基化引言
N-連鎖糖基化、改造和降解參與了從古生菌到真核生物的所有生物的各種過程。它是真核細胞中最常見的共價蛋白質修飾。沒有任何其他的蛋白質翻譯後修飾具有如此複雜的化學性質或如此多樣化的功能。
結構
所有N-連接的聚糖都是基於共同的核心五糖,Man3GlcNAc2 (圖 1)。在高尔基体中的进一步加工会产生三大类 N-连接的糖类:
- 高甘露糖
- 杂糖
- 复合糖

圖 1. 所有 N 連結聚糖的核心結構。
高甘露糖包含未取代的末端甘露糖(圖 2)。這些聚糖通常包含五到九個接在殼寡糖(GlcNAc2)核心的甘露糖殘基。名稱縮寫表示結構中甘露糖殘基的總數。

圖 2. 高甘露糖 Man-5(上)和 Man-9(下)的例子。
雜交聚糖的特徵是同時含有未取代的末端甘露糖殘基(如高甘露糖中的甘露糖殘基)和具有 N-乙酰葡糖胺連結的取代甘露糖殘基(如複合聚糖中的甘露糖殘基)(圖 3)。這些添加到混合和複合 N-聚糖中的 N-連接聚糖核心的 GlcNAc 序列稱為「天線」。圖 3 Figure 3 所示的最上層結構是雙天線聚糖,有兩個 GlcNAc 分支與核心連結。較低的結構是具有三個 GlcNAc 分支的三端聚糖。
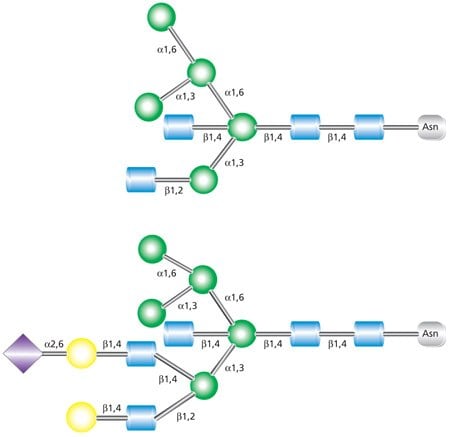
圖 3. 雙年期 (上) 和三年期 (下) 混合聚糖的範例。
複合 N-連接的聚糖與高甘露糖和雜交聚糖的不同之處在於α-3 和 α-6 甘露糖位點上都添加了 GlcNAc 殘基(圖 4)。與高甘露糖的聚糖不同,複合聚糖除了核心結構之外不含甘露糖殘基。額外的單糖可能出現在重複的乳糖胺 (GlcNAc-β(1→4)Gal) 單位中。複合聚糖以二、三和四陽極的形式存在,並構成大部分的細胞表面和分泌型 N-聚糖。複合聚糖通常以矽酸殘基為終端。也可能有其他修飾,例如在甘露糖基核心(如 圖 4所示)增加一個二叉的 GlcNAc 和/或在最內側的 GlcNAc 上增加一個岩藻糖基殘基。
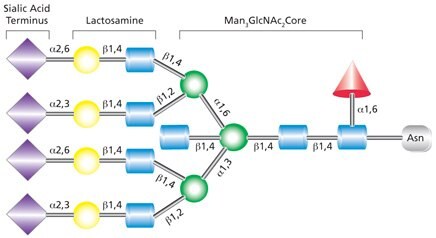
圖 4. 包含末端矽酸殘基、五糖核心上的二叉 GlcNAc,以及核心 GlcNAc 上的岩藻糖基化的四元複合糖範例。
生物合成和降解
N-連接聚糖的蛋白質糖基化實際上是一個共轉譯事件,發生在蛋白質合成過程中。N-連結的糖基化發生在共識序列 Asn-X-Ser/Thr 上,其中聚糖附著在天冬酰胺的胺基上,而 X 代表除脯氨酸以外的任何胺基酸。
要納入蛋白質的寡糖中間物是由一系列轉移酶在內質直鏈(ER)的胞質側合成的,同時與磷酸多糖(P-Dol)基相連。通常使用 GDP-Man 和 UDP-GlcNAc 作為糖供體,在添加甘露糖和 N- 乙酰基-D-葡萄糖胺分子之後,從 ER 的細胞質側移動之前的最終構造是 Man5GlcNAc2-P-Dol(圖 5)。
這種附有聚糖的 dolichol 前體被移到 ER 的內腔(「翻轉」)進一步酵素修飾。處理過程包括由糖苷酶修剪葡萄糖和甘露糖殘基,以及在 ER 和在很大程度上在高爾基內經由糖基轉移酶加入新的殘基。在高爾基體中,高甘露糖 N-聚糖可以轉換成脊椎動物特有的各種複雜和混合形式。完成的寡糖再經由寡糖基轉移酶 (OST) 從多寡糖前體轉移到目標蛋白質的 Asn 上。
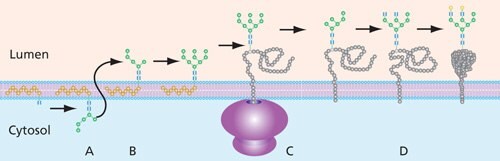
圖 5. ER中N-連結聚糖構造的一般過程。聚糖前體在 ER 的細胞質(A)中組裝在磷酸多立醇基(Dolichol phosphate base)上。一旦聚糖被轉換到管腔一側 (B),聚糖會在附著到蛋白質 (C) 之前添加或移除(修剪)其他糖,並在此進行其他加工 (D)。
裂解的高甘露糖在高爾基體中作為底物,在高爾基體中發生額外的修飾和多樣化。高甘露糖結構在甘露糖苷酶的作用下被修剪,去除甘露糖延伸部分,並在 N-乙酰葡萄糖基轉移酶的作用下,通過隨後添加的 GlcNAc 糖(「觸角」)使聚糖可用於轉換為雜交和複合聚糖。哺乳類動物的基因 Mgat1 代碼 N-乙酰葡萄糖基轉移酶-I (GlcNAcT-I),負責在β(1→2) 連結中加入一個 GlcNAc。之後,經修飾的聚糖會成為α-甘露糖苷酶 II 的底物,α-甘露糖苷酶 II 會移除α(1→3) 和 α(1→6) 甘露糖殘基6)甘露糖殘基,並形成可由 GlcNAcT-II(N-乙酰葡萄糖基轉移酶-II)捐贈葡萄糖基的分子結構,而 GlcNAcT-II(N-乙酰葡萄糖基轉移酶-II)是由 Mgat2 基因編碼的。Catalysis by GlcNAcT-II converts the hybrid glycans to the complex forms by attaching additional GlcNAc moieties to the hybrid structure.
Fucosylation at the core GlcNAc residue following GlcNAcT-I modification in both hybrid and complex N-linked synthesis is also a common occurrence.在脊椎動物中,岩藻醣是以α(1→6)連結方式加入,而在植物和無脊椎動物中,岩藻醣則是以α(1→3)連結方式加入。
在研究N-連結聚糖時,糖基化的抑制或消除可由多種化合物帶來。在compactin、輔酵素Q或外源膽固醇的存在下,N-糖基化會被強烈抑制。
α-甘露糖苷酶、β-甘露糖苷酶、纈草糖苷酶和 α-岩藻糖苷酶是參與 N-連接糖修剪和降解的主要外糖苷酶。昆蟲細胞會表達一種 N-acetylglucosminidase,它會從 N 連接的聚糖中裂解末端 GlcNAc 殘基。
功能
在發育過程中,糖蛋白的中間結構會執行特定的功能。在糖蛋白演化的早期階段,不同的核心寡糖結構對於蛋白質的正確折疊和功能基團定向是必要的。折疊不當的蛋白質會被重新糖基化並重新折疊,或是被脫糖基化並降解。在後期階段,寡糖分子是糖蛋白在細胞內轉運及在內質網體、高爾基複合體及經高爾基網體中定位所必需的。在最後階段,N-連接的聚糖在高爾基複合體中經過廣泛的修飾,形成成熟的糖蛋白。
蛋白質分子和附著的親水 N-連接聚糖儘管是共價連結,但相對獨立,即聚糖可以被修飾而不會顯著影響蛋白質的結構和功能。蛋白質可能含有多個糖基化位點,而這些位點是由三類 N-連接聚糖中的任何一種所修飾。脊椎動物已被發現擁有多種複雜的混合糖蛋白,這是由於基因組內編碼了多種糖苷酶和糖基轉移酶。
除了一種特定的糖蛋白可以包含多種聚糖結構之外,同一種糖蛋白的不同分子也可能有不同的聚糖結構附著在相同的取代位點上。聚糖結構的修飾提供了不同細胞類型以及相同細胞類型在發育、分化、轉型、維持和老化階段的身分特徵。蛋白質糖基化的這種變異被稱為微異構性質(microheterogeneity),是造成鑑定和分離特定糖蛋白困難的原因之一。
先天性糖基化障礙(congenital disorders of glycosylation,CDG)是一系列與酵素缺乏導致的代謝錯誤有關的疾病。大多數已發現的 CDG 都是由於缺乏其中一種參與 N-糖基化的酵素(主要是外糖苷酶 α-甘露糖苷酶、β-甘露糖苷酶、纈草糖苷酶或 α-岩藻糖苷酶),而導致 N-聚糖的生物合成或降解失敗。
Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。