Imprint® RNA免疫沉淀试剂盒用于从HeLa细胞中共同纯化人argonaute 2 (Ago2)相关RNA,如技术公报中所述。為了評估此試劑盒可能的不同嚴格度選項,我們測試了溫和與嚴苛的裂解緩衝液,並在試劑盒提供的溫和洗滌緩衝液中添加 0.95% Igepal 和 0.75 M NaCl 到試劑盒的洗滌緩衝液(最終濃度 = 1% Igepal, 0.9 M NaCl),以製備更嚴格或嚴苛的洗滌緩衝液。對於每個 RNA 免疫沉澱 (RIP),200 萬個 HeLa 細胞用溫和或苛刻的裂解緩衝液裂解,免疫沉澱 2.5 µg 的陰性對照抗體 (IgG; Ago2-specific antibody (SAB4200085),并用试剂盒中的温和洗涤缓冲液或上述制备的苛刻洗涤缓冲液进行洗涤。所用抗體的特異性 (Ago2 antibody SAB4200085)SAB4200085;克隆11A9)及其免疫沉淀的适用性之前由Ameyar-Zazoua等人2012(Nat Struc Mol Biol 19, 998; 图3c.),通過 Western Blot 與 Ago2 敲除和不敲除。因為 SAB4200085 是在大鼠中產生的單克隆,兔抗大鼠(R9255; 2.5 µg) IgG 作為橋接抗與試劑盒的蛋白A磁珠一起使用。對於每種裂解和洗滌條件組合(溫和裂解/溫和洗滌, 圖 2)進行重複免疫沉淀。a href="#fig2「>圖 2;嚴格裂解/溫和水洗, 圖 3;嚴格裂解/苛刻水洗, 圖 4)。純化 Ago2- 相關 RNA 之後,使用 MystiCq® microRNA cDNA Synthesis Mix (Fig4) 進行 RT-qPCR。a href="/product/sigma/MIRRT" target="_self">MIRRT)、MystiCq® microRNA® SYBR和nbsp;SYBR® Green qPCR ReadyMix (MIRRM01), 和MystiCq® microRNA® ?),以及3個miRNAs的MystiCq引物,分別是hsa-let-7c (let7c)、hsa-miR125a-5p (miR125a)、hsa-miR191-5p (miR191),以及2個對照的小RNAs (RNU6和SNORD48)。ReadyScript® cDNA Synthesis Mix (RDRT)、KiCqStart® SYBR
預期所有的 miRNA 都會與 anti-Ago2 結合並共免疫沉淀。此外,DICER1 和 MYC 都是已發表的 let7c 靶點 (Carcinogenesis 29, 2073; BMC Mol Biol 8, 79),因此應該會與 Ago 2 RIP 一起回收。另一方面,GAPDH 在 HeLa 細胞中並不是任何 miRNA 的靶點,因此可作為非靶點的陰性對照。雖然有些小核 RNA 已被證實會與 Ago2 結合並共免疫沉淀 (Nat Struc Mol Biol 19, 998),但 RNU6 並不在 Ago 2 結合的小 RNA 之列。此外,在已發表的研究中,來自離體核的染色質部分被用於 RIP。在這裡所使用的全細胞萃取物中,這樣的互作非常罕見,無法檢測到。有報告指出,源自數個小核細胞 RNA 的小 RNA 與 Ago2 共免疫沉淀,功能類似 miRNA (Mol Cell 32, 519)。然而,SNORD48 並不是報告中的小核 RNA 之一。因此,let7c、miR125a、miR191、DICER1 和 MYC 都應該可以在 Ago 2 RIPs 中檢測到,而 RNU6、SNORD48 和 GAPDH 則不應該。
如 圖 1-4所示,無論使用哪種裂解和洗滌條件組合,本評估進行的 RIPs 都非常乾淨。高水平檢測到的 miRNA 的結果顯示在圖 A 面板,低水平檢測到的非目標控制 RNA 和 mRNA 的結果則顯示在各圖的 B 面板。兩者皆以輸入 RNA 的百分比表示。使用 Ago2 特異性抗體回收的 Ago2 目標 RNA(let7c、miR125a、miR191、DICER1 和 MYC)比非目標 RNA(RNU6、SNORD48 和 GAPDH)多 2.5 到 105 倍以上。此外,Ago 2 RIP 與非特異性 IgG 相比,目標 RNA 富集了 100 到 10,000 倍,而非目標 RNA 則富集了 0.4 到 24 倍。需要注意的是,let-7c 和 miR- 125a 的確切輸入百分比值並不可靠。在免疫沉淀之前,只有8%的细胞裂解液被保留下来,用来计算输入%,因此,let-7c和miR-125a的产量是推算出来的。
温和的裂解和温和的洗涤是这里使用的抗体和RNA靶标进行RIP的最佳条件。在這些條件下,Ago 2 目標 RNA 的產率最高,而且能充分區分目標和非目標 RNA。可能需要更嚴苛的裂解和/或水洗條件,以區分目標RNA含量較少的目標和非目標RNA。本文報告的結果顯示,對於含量較少的目標 RNA,溫和的裂解與嚴厲的洗滌可能是有益的。與其他的裂解和洗滌組合相比,這些條件所得到的信噪比幾乎是兩倍,因此能最好地區分目標和非目標(表 1)。
報告了每種裂解和洗滌條件組合獲得的最高和最低信噪比。為了計算最高信噪比,最豐富的 Ago2 目標 (let7c) 的產率 (% input) 除以最不豐富的非目標 RNA (SNORD48) 的產率,得出 let7c/SNORD48。同樣地,為了計算最低信噪比,用含量最少的 Ago2 目標 (DICER1) 除以含量最多的非目標 RNA (GAPDH),得出 DICER1/GAPDH。數值四捨五入至 2 個顯著數字,並分別報告重複 RIPs 的結果 (RIP#1 & RIP#2).
上述實驗使用 Ago1 抗體 (clone 4B8, SAB4200084) 代替 Ago2 抗體重複進行。雖然在 Ago1 RIP 中檢測到的 3 種 miRNAs 的數量比在 IgG RIP 中或 Ago1 RIP 中的非目標小 RNAs 高,但與 Ago2 RIP 相比,產量極低(let7c = 0.4 至 1.7 %,Ago1 的產量為 0.4 至 1.7 %,Ago2 的產量為 20 至 90 %)。此外,與非目標 mRNA(GAPDH;數據未顯示)相比,2 個目標 mRNA(DICER1 和 MYC)並未被選擇性回收。
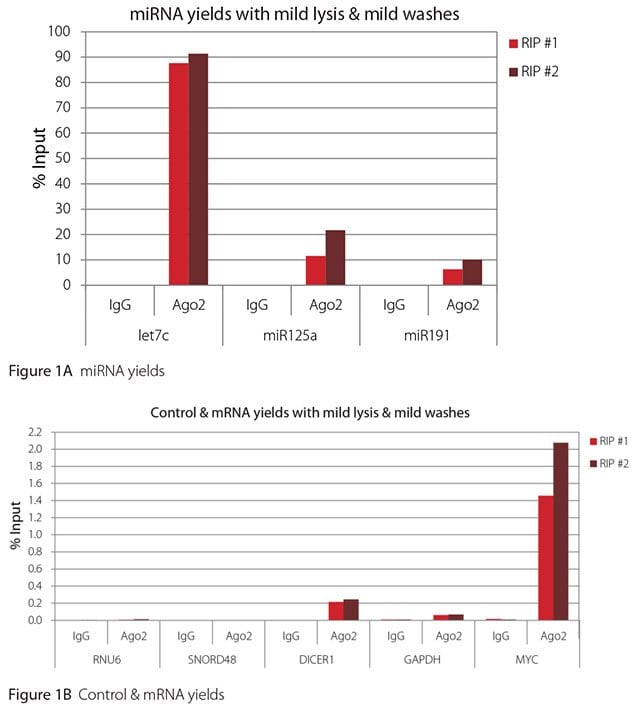
圖 1.Ago2 RIP 的 RT-qPCR 結果,含溫和裂解和溫和清洗
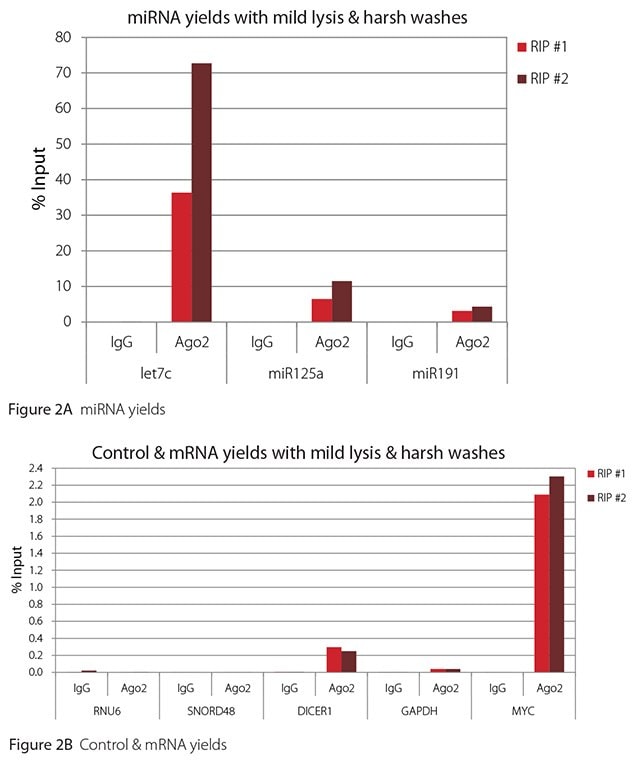
圖 2. Ago2 RIP 的 RT-qPCR 結果,有溫和的裂解和嚴厲的洗滌
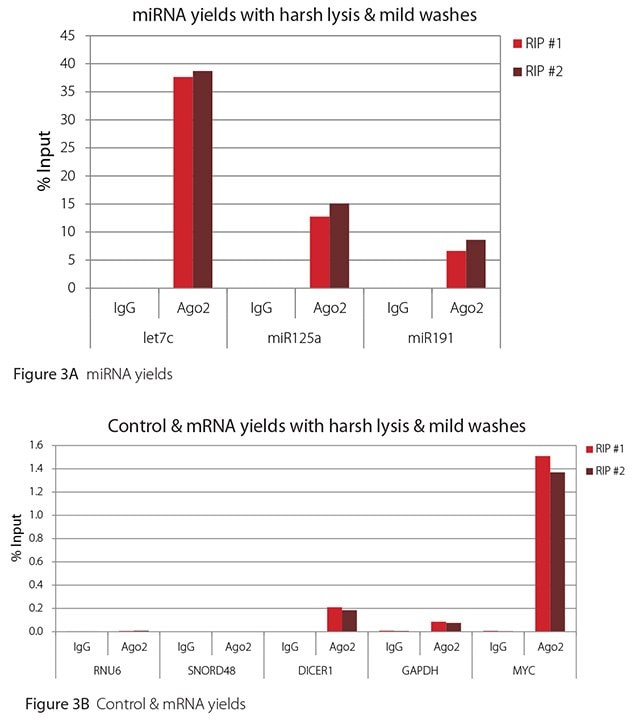
圖 3. Ago2 RIP 的 RT-qPCR 結果,採用嚴苛的裂解和溫和的洗滌方式
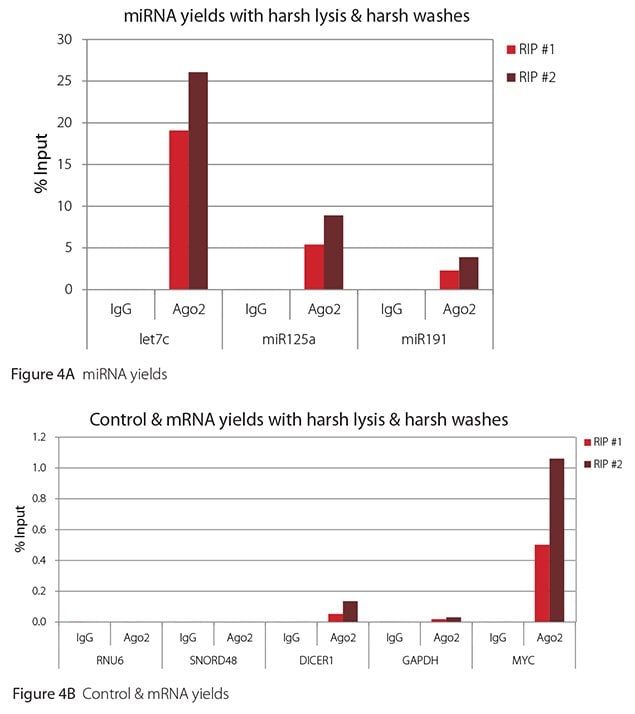
圖 4. Ago2 RIP 的 RT-qPCR 結果與苛刻裂解和苛刻洗滌的結果
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?