T細胞殺死試驗
T細胞是人體免疫系統的重要組成部分,對於對抗癌症腫瘤或感染至關重要。今天,新的免疫療法正在開發中,這些療法可以活化 T 細胞並增強其效應功能,抑制抑制機制,或使 T 細胞靠近其靶細胞。T 細胞殺傷力檢測可用於判斷新藥的效力、新型免疫療法的免疫調節,以及利用動物模型挑選有潛力的候選者進行藥物研究。
隨著最近在 3D cell culture and organoid technology, multiple T cell killing assays have been established to test T cell functionality and response to immunotherapys in vitro.在這裡,我們的穩健且可擴展的T細胞誘殺實驗評估了患者衍生的腫瘤浸潤淋巴細胞(TIL)結合免疫調節劑對自體 人結直腸癌腫瘤球 使用 Millicell® Microwell 96 孔板。由於使用源自患者的腫瘤球體和 TIL,因此該檢測可進行患者特異性檢測。
什麼是 Millicell® 微孔板?
目前的 T 細胞凋亡分析系統處理量有限,通常難以處理,而且重複性低。這使得它們難以擴展至高通量或篩選應用。Millicell® Microwell 96 孔板是一種即用型平台,可用於可擴展、可重複的類器官培養。
板中的孔包含即用型聚乙二醇 (PEG) 水凝膠溶液,無外部固體細胞外基質 (ECM) 是必需的。孔內的 PEG 溶液具有生物相容性,可讓幹細胞有效聚集。
由於在孔內形成的球體或有機體在單一焦點平面上,Millicell®微孔板是自動化工作流程和成像的理想選擇。為了防止微組織流失,Millicell® Microwell 細胞板還設有一個培養基交換口,可在不干擾微組織的情況下輕鬆交換培養基。這種標準化、均勻的類器官培養,是輕易實現 3D 細胞培養研究應用的理想選擇。

圖 1. A。Millicell® 微孔板 T 細胞殺死試驗概述。體外T 細胞殺死試驗系統示意圖。從左至右:外部 ECM-嵌入(例如 Matrigel)、非黏附表面、Millicell® Microwell 板。 B.使用 Millicell® Microwell 96 孔板形成的腫瘤球體的明視野圖片。
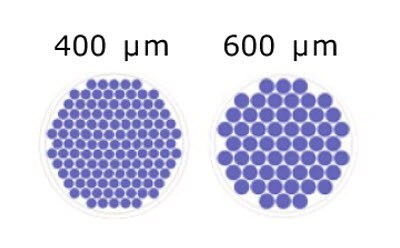
圖 2.Millicell® Microwell 96 孔板的微孔數量/孔基於微孔尺寸的示意圖。
T Cell Killing Assay Protocol
使用此方案,在單孔中形成腫瘤球體,並與 TILs 共同培養。T 细胞杀伤潜能使用半自动图像分析,并在原位执行。
- 使用 600μm Millicell® Microwell 96 孔板中的 O 型環,將人類結腸直腸癌球形細胞形成細胞株送入微孔中。
- 透過培養基交換口加入培養基。注意:如果需要 ECM,可將其稀釋入培養基,並在此步驟中加入。
- 讓腫瘤球體生長並完全發育。
- 添加 TIL,直到達到所需的效靶 (E:T) 比值。注意:本檢驗在免疫調節劑 IL2、CD3(IL2 + -CD3/CD28)和 PD1(IL2 + -CD3/CD28 + -PD1/CTLA4)存在或不存在的情況下進行。
- 使用細胞追蹤器1監測隨時間變化的生長情況。在這項檢測中,腫瘤細胞、T 細胞和死亡細胞分別用遠紅色追蹤劑(藍色,CellTrace™ Far Red Cell Proliferation Kit; Molecular Probes)、CFSE(綠色)和碘化丙啶(紅色)標記。
對於 T 細胞染色:
- 將細胞重懸於 CFSE 染色液中(1:200 於檢測緩衝液中,再以 1:2 於溫 PBS 稀釋),並於 37˚C 孵育 20 分鐘。
- 加入等容量的含 10% FBS 的培養基,培養 10 分鐘。
- 以 200xg 脫水 5 分鐘。
- 將細胞重懸於所需濃度的培養基;例如 10M cells/ml。
對於器官樣染色:
- 將細胞重懸於 1ml 含微量(1:1000)的溫 PBS 中,在 37˚C 孵育 20 分鐘。
- 加入等量的培養基(DMEM + 10% FBS),37˚C 培養 5 分鐘。
- 將細胞重懸於 1 ml 培養基。
- 加入碘化丙啶染色以評估 T 細胞殺害。碘化丙啶的稀釋取決於供應商的建議。
- 進行半自動圖像分析,量化細胞死亡、腫瘤大小和 TIL 移動。
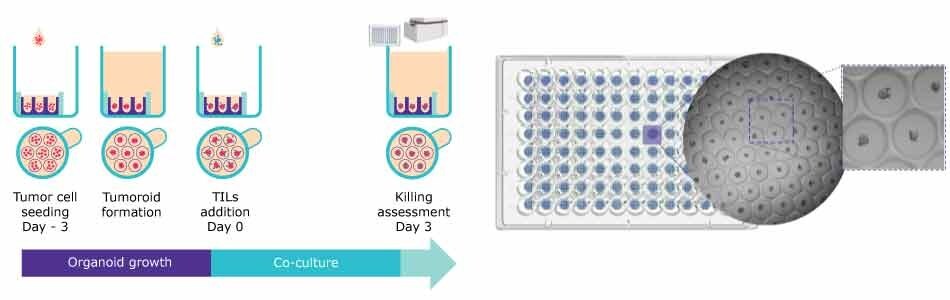
圖 3. 使用 Millicell® Microwell 96 孔板的 T 細胞殺滅方案。 A.類器官生長和形成以及評估與 TILs 共同培養的檢測工作流程。 B.人類結腸直腸腫瘤球體的代表性光場影像。

圖 4.患者衍生的結腸直腸腫瘤球體和自體 TILs 共培養評估。 A。腫瘤細胞(藍色)的明視場顯微鏡圖像,T 細胞 10:1 E:T 比例(綠色)和死細胞(紅色)。縮放條 500μm。B.第 3 天碘化丙啶染色的定量;C.第 3 天腫瘤球形面積的量化。
這種檢測方法使用 Pmel-1 轉基因小鼠模型進行了驗證。黑色素瘤腫瘤球體在有 T 細胞存在的情況下被破壞,但在沒有 T 細胞的情況下仍能穩定生長。正如在體外T細胞殺死實驗中所看到的,高E:T比率會導致更有效的腫瘤殺死。

圖 5.Pmel-1 小鼠模型 T 細胞殺死試驗。 A。B16-F10 黑色素瘤腫瘤球體與靶向 T 細胞以 10:1 E:T 共培養的光場成像。縮放條 500μm。B.第 2 天碘化丙啶濃度的量化。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。