Różnicowanie pierwotnych ludzkich osteoblastów
Osteoblasty (HOB) to wyspecjalizowane komórki fibroblastów, które wydzielają i mineralizują macierz kostną. Rozwijają się one z prekursorów mezenchymalnych. Zmineralizowana macierz zewnątrzkomórkowa składa się głównie z kolagenu typu I i mniejszych, ale znaczących ilości osteokalcyny (OC), białka gla macierzy, osteopontyny (OPN), sialoproteiny kostnej (BSP), BMP, TGFβ i nieorganicznego minerału hydroksyapatytu. Różnicowanie osteoblastów można scharakteryzować w trzech etapach: (a) proliferacja komórek, (b) dojrzewanie macierzy i (c) mineralizacja macierzy.1 In vitro, dojrzewanie macierzy i mineralizacja są zwykle wzmacniane przez hodowlę komórek do pełnej konfluencji i dodanie specyficznych czynników osteogennych.2 Podczas proliferacji można wykryć kilka białek macierzy zewnątrzkomórkowej (prokolagen I, TGFβ i fibronektyna). Faza dojrzewania macierzy charakteryzuje się maksymalną ekspresją fosfatazy alkalicznej (AP). Wreszcie, na początku mineralizacji macierzy, geny dla białek takich jak OC, BSP i OPN ulegają ekspresji, a po zakończeniu mineralizacji odkładanie wapnia można wizualizować za pomocą odpowiednich metod barwienia. Analiza markerów specyficznych dla komórek kostnych, takich jak AP, OC i kolagen typu I lub wykrywanie funkcjonalnej mineralizacji jest często wykorzystywana do scharakteryzowania osteoblastów in vitro.2 Proces mineralizacji osteoblastów w hodowli in vitro został również wykorzystany jako model do testowania wpływu leczenia farmakologicznego i obciążenia mechanicznego na różnicowanie komórek kostnych i tworzenie kości.3, 4 PromoCell oferuje pierwotne ludzkie osteoblasty wyizolowane z tkanek dorosłych indywidualnych dawców (C12720, C12760) wraz ze zoptymalizowanym wzrostem (C27001) i mineralizacją (C27020) mediów, aby zapewnić stałą wydajność hodowli komórek.

Rysunek 1.Przegląd tworzenia i mineralizacji kości przez osteoblasty.
Protokół różnicowania osteoblastów
- Siej osteoblasty (HOB) na płytkach hodowlanych pokrytych kolagenem.4 HOB na studzienkę na 24-dołkowej płytce do hodowli tkankowej pokrytej kolagenem typu 1 (C3867). Pracować w dwóch powtórzeniach. Użyj HOB Growth Medium (C-27001) dla jednej studzienki jako kontroli negatywnej i Osteoblast Mineralization Medium (C-27020) dla drugiej studzienki.
- Hodowla różnicująca indukowanych osteoblastów. Inkubuj komórki przez 17-21 dni. Zmieniaj pożywkę co trzeci dzień. Należy uważać, aby nie naruszyć monowarstwy komórek.
Wykrywanie złogów wapnia (mineralizacja)
- Płukanie komórek.Wyjmij komórki z inkubatora i ostrożnie zassij pożywkę. Ostrożnie przemyj komórki PBS Dulbecco, bez Ca++/Mg++ (D8537).
- Utwierdzenie komórek. Ostrożnie odessij PBS i dodaj wystarczającą ilość roztworu utrwalającego Saccomanno, aby pokryć monowarstwę komórek. Po co najmniej 60 minutach delikatnie odessać roztwór utrwalający i przemyć komórki wodą destylowaną.
- Stain the cells. TMS008) przez filtr 0,22 μM Millex PES. Ostrożnie odessać wodę destylowaną i dodać wystarczającą ilość przefiltrowanego roztworu barwiącego Alizarin Red S, aby pokryć monowarstwę komórkową. Inkubować w temperaturze pokojowej w ciemności przez 45 minut.
- Płukanie komórek. Ostrożnie odessać roztwór barwiący czerwieni alizarynowej S i czterokrotnie przemyć monowarstwę komórek 1 ml wody destylowanej. Ostrożnie odessać wodę destylowaną i dodać PBS.
- Natychmiast przeanalizować próbkę, ponieważ barwnik może krwawić po dłuższym przechowywaniu bez osadzania. Niezróżnicowane HOB (bez zewnątrzkomórkowych złogów wapnia) są lekko czerwonawe, podczas gdy zmineralizowane osteoblasty (z zewnątrzkomórkowymi złogami wapnia) są jaskrawo pomarańczowe.
Wykrywanie fosfatazy alkalicznej
- Przygotuj roztwory i odczynniki.B5655) w 10 ml wody destylowanej, aby przygotować roztwór substratu. Przechowywać w ciemności i zużyć w ciągu 2 godzin. Dodać 0,05% Tween 20 (P2287) do PBS, bez Ca++/Mg++ (D8537), aby przygotować bufor do płukania.
- Wash the cells. Wyjmij komórki z inkubatora i ostrożnie zassij pożywkę. Ostrożnie umyj komórki PBS.
- Utrwal komórki. Ostrożnie odessij PBS i dodaj wystarczającą ilość roztworu utrwalającego Saccomanno, aby pokryć monowarstwę komórek. Po 60-90 sekundach delikatnie odessać roztwór utrwalający i przemyć komórki buforem do przemywania.Uwaga: Dłuższe utrwalanie doprowadzi do nieodwracalnej inaktywacji AP.
- Stain the cells. Ostrożnie odessać bufor do przemywania i dodać wystarczającą ilość roztworu substratu BCIP/NBT, aby pokryć monowarstwę komórek. Inkubować w temperaturze pokojowej w ciemności przez 510 minut. Sprawdzać postęp barwienia co 23 minuty.
- Umyć komórki. Ostrożnie odessać roztwór substratu i umyć monowarstwę komórek buforem do mycia. Ostrożnie odessać bufor płuczący i dodać PBS.
- Analiza komórek. Oceń wyniki barwienia.

Rysunek 2. Mikroskopowy wygląd HOB po mineralizacji in vitro. A) Zmineralizowane osteoblasty w Osteoblast Mineralization Medium wykazują rozległe pozakomórkowe złogi wapnia, zabarwione na jaskrawo pomarańczowo-czerwony kolor. Po prawej: Kontrola negatywna w HOB Growth Medium jest lekko czerwonawa.
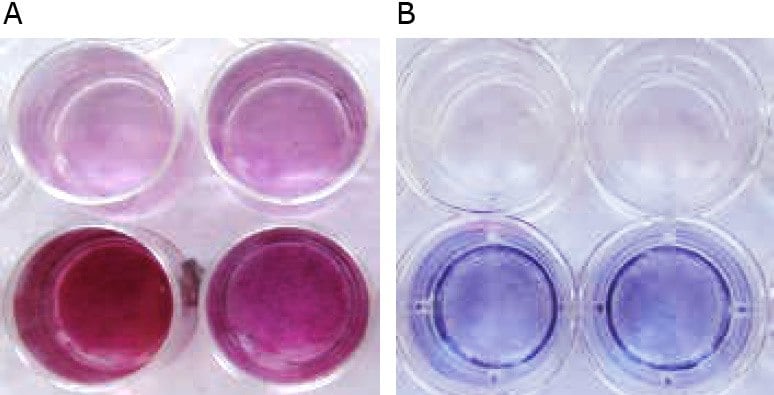
Rysunek 3. Makroskopowy wygląd HOB po mineralizacji in vitro. A) Kontrola negatywna w pożywce do wzrostu osteoblastów (górny rząd) jest lekko czerwonawa, podczas gdy zmineralizowane osteoblasty w pożywce do mineralizacji osteoblastów wykazują rozległe pozakomórkowe złogi wapnia, zabarwione na jasno pomarańczowo-czerwony kolor (dolny rząd). B) HUVEC (AP ujemne, górny rząd) są bezbarwne lub lekko niebieskawe, podczas gdy osteoblasty (AP dodatnie, dolny rząd) są ciemnoniebiesko-fioletowe. Im wyższa aktywność AP, tym intensywniejszy kolor.
Network error: Failed to fetch
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.