Testy tworzenia barier i przepuszczalności przy użyciu wiszących wkładów do hodowli komórkowych Millicell®
Przeczytaj o
- Przegląd testu bariery
- Co jest potrzebne do przeprowadzenia testu na obecność żółtego Lucyfera?
- Wybór Millicell® Hanging Cell Culture Insert
- Metoda detekcji TEER
- Notatki aplikacyjne, przewodniki i inne zasoby dotyczące TEER
- .Lucifer Yellow Barrier Assay Sample Protocol
- Dane próbki testu Barrier Assay
- Wskazówki i porady dotyczące testu Barrier
- .Barrier Assay Tips and Tricks
- Powiązane produkty
- Referencje
Barrier Assay Overview
Badania barier w hodowlach komórkowych są wykorzystywane do modelowania tkanek barierowych (nerek, płuc, jelit itp.) w dostarczaniu leków, absorpcji leków, gojeniu się ran, infekcjach bakteryjnych/wirusowych, stanach zapalnych i innych badaniach. Bariery te mogą być tworzone in vitro , gdy komórki nabłonkowe są wysiewane jako pojedyncza zawiesina komórek i rosną razem, aż do połączenia w jedną tkankę. Zazwyczaj tkanka ta ma grubość jednej komórki nabłonkowej i jest nazywana monowarstwą nabłonkową. W standardowych testach barierowych komórki są wysiewane na porowate membrany i obserwowane nieinwazyjnie poprzez pomiary przeznabłonkowego oporu elektrycznego (TEER). Pomiary TEER są zweryfikowanymi, wolnymi od etykiet i szybkimi technikami wskazującymi na tworzenie bariery monowarstwy nabłonkowej przed dalszą oceną i eksperymentami. Tworzenie bariery obserwuje się poprzez wzrost pomiaru oporu; konfluentna monowarstwa nabłonkowa osiąga plateau przy wyższych wartościach oporu. W przypadku większości testów barierowych, monowarstwa nabłonkowa jest pożądanym typem bariery komórkowej, ponieważ modeluje grubość pojedynczej komórki płuco-krew, filtrację nerkową lub wchłanianie jelitowe i może być stosowana do analizy przestrzeni parakomórkowej między komórkami nabłonkowymi. Po potwierdzeniu integralności bariery komórkowej, tkanki te mogą być następnie wykorzystane w eksperymentach, które badają przepuszczalność, przerwanie lub wytrzymałość bariery.
Pory połączeń ścisłych są fizjologicznymi strażnikami transportu parakomórkowego w tkankach nabłonkowych. Testy przepuszczalności parakomórkowej oceniają tworzenie bariery jednowarstwowej i szczelność połączeń ścisłych parakomórkowych poprzez pomiar ilości cząsteczki, która przechodzi przez monowarstwę komórek nabłonkowych w określonym czasie. Ten typ testu wymaga żywych komórek i zwykle nie jest destrukcyjny (np. test przepuszczalności parakomórkowej z użyciem żółci Lucifera). Immunobarwienie i immunocytochemia tkanek (ICC) są powszechnie stosowane do wizualizacji, eliminując potrzebę mikroskopii elektronowej. Wiele z tych analiz koncentruje się na przejściu przez barierę śledzonym jako barwnik, koniugaty leków lub ilość przeniesionego białka docelowego. Alternatywne analizy obejmują wizualizację błony przy użyciu barwników, takich jak fiolet krystaliczny, barwienie przeciwciałami fluorescencyjnymi i ICC.
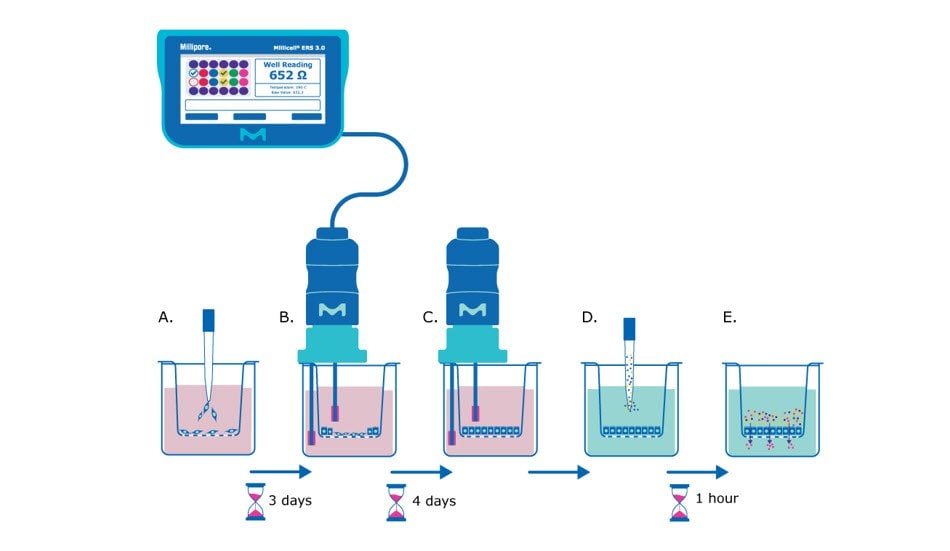
Rysunek 1. Zasada testu barierowego przy użyciu wiszących wkładów do hodowli komórkowych Millicell®. A) W dniu 0, komórki nabłonkowe są wysiewane w zawiesinie jednokomórkowej na membranę wiszącej wkładki do hodowli komórkowej Millicell®. B) Po kilku dniach (~3 dni po wysianiu w przypadku komórek MDCK) komórki będą wystarczająco zlewne, aby rozpocząć pomiary TEER, oceniając tworzenie monowarstwy komórek nabłonkowych na podstawie wartości oporu. C) Pomiary TEER można wykonywać codziennie lub co drugi dzień, aby śledzić tworzenie bariery jednowarstwowej, aż do momentu, gdy komórki osiągną stałą wartość oporu (~ 7 dni po wysianiu dla komórek MDCK). D) W tym momencie pożywka jest wymieniana na płyn do oznaczania bariery (zrównoważony roztwór soli Hanka), a barwnik/cząsteczka do oznaczania przepuszczalności (np. żółty barwnik Lucifera) jest dodawany do wierzchołkowej strony membrany. E) Małe cząsteczki są inkubowane z monowarstwą nabłonka w temperaturze 37°C przez zalecaną długość protokołu (np, 1 godzinę), a następnie ciecz z podstawno-bocznej strony wkładu membrany jest oceniana pod kątem ilości przenikania wybranej cząsteczki.
Co jest potrzebne do przeprowadzenia testu bariery Lucifer yellow?
- Wisząca wkładka do hodowli komórkowej Millicell® o wielkości porów 0,4 lub 1 µm (patrz Wybór wiszącej wkładki do hodowli komórkowej Millicell® poniżej)
- Płytka odbiorcza (CLS353046, CLS353043, CLS353047)
- żółty barwnik Lucifera
- Zrównoważony roztwór soli Hanka
- Millicell® ERS 3.0 Digital Voltohmmeter
- Czytnik mikropłytek
- 96-dołkowa mikropłytka z czarnym/przezroczystym dnem
.Wybór wiszącej wkładki do hodowli komórkowej Millicell®
Testy barierowe są wykonywane na wiszących wkładkach, ponieważ porowate membrany oferują znacznie lepsze właściwości w porównaniu ze standardowymi powierzchniami polistyrenowymi do tak zwanej hodowli komórek 2.5D. Membrany w tych wkładkach różnią się pod względem wielkości porów, co staje się ważne dla różnych typów testów. Na przykład testy migracji będą miały najszerszy zakres rozmiarów porów w zależności od typu komórek zaangażowanych w eksperyment.
Metoda wykrywania TEER
Woltomierz Millicell® ERS 3.0 wykorzystuje niskie natężenie prądu i napięcia, aby umożliwić nieniszczące badanie zrastania się monowarstw nabłonka w hodowlach komórkowych. Instrumenty TEER wytwarzają niski prąd przemienny, który pozwala uniknąć osadzania się metalu na elektrodach i niekorzystnego wpływu na tkanki, który może być spowodowany przez wyższe prądy stałe. Konfluencja monowarstwy komórkowej jest określana przez wzrost lub plateau oporności tkanki wykrywane za pomocą czytników TEER.
Podłoża hodowlane MDCK
- Dulbecco's MEM z wysoką zawartością glukozy
- 10% FBS
- 1% (1x) NEAA
- 1% penicylina/streptomycyna
- 4 mM L-glutaminy
Nasiewanie komórek na 24-dołkową wiszącą wkładkę do hodowli komórkowej Millicell®
- Kultura komórki MDCK aż do uzyskania 60-80% konfluencji.
- Aspiruj pożywkę z kolby hodowlanej.
- Dodaj sterylny PBS przez 3 minuty w temperaturze pokojowej.
- Odessać płyn z kolby hodowlanej.
- Dodać trypsynę do kolby hodowlanej i inkubować w temperaturze 37°C, 5% CO2 w inkubatorze do hodowli komórkowych.
- Zatrzymaj reakcję trypsyny dodając równe części kompletnego podłoża do hodowli komórkowej do kolby.
- Zbierz płynną zawiesinę i odwiruj w wirówce z prędkością 300 x g przez 3 minuty.
- Zawiesić ponownie komórki w 1 ml pełnej pożywki do hodowli komórkowej (patrz przepis na pożywkę do hodowli MDCK powyżej).
- Liczyć komórki przy użyciu błękitu trypanu i hemocytometru. Zmieszaj 90% błękitu trypanu z 10% zawiesiny komórek (np, 180 µL błękitu trypanu i 20 µL zawiesiny komórek).
- Zlicz żywe komórki na hemocytometrze i oblicz liczbę komórek na mililitr.
- Dodaj 900 µL pełnej pożywki na podstawną stronę 24-dołkowych membran.
- Zawiesić zawiesinę komórek w odpowiednich objętościach, aby dozować 200 µL zawiesiny zawierającej pożądaną gęstość wysiewu komórek (np, 1,250 komórek/wkładkę, 2,500 komórek/wkładkę, 5,000 komórek/wkładkę).
- Umieść w inkubatorze do hodowli komórkowych w 37°C, 5% dwutlenku węgla i zmieniaj pożywkę co drugi dzień.
UWAGA: Najlepszą praktyką jest wstępne ogrzanie pełnej pożywki do hodowli komórkowej przed dodaniem jej do wiszącego wkładu do hodowli komórkowej Millicell® i płytki odbiorczej.
Pomiar oporności komórek
- Pozwolić płytce osiągnąć temperaturę pokojową (15-30 minut).
- Załaduj mapę płytki i przypisz studzienki do grup na woltomierzu cyfrowym Millicell® ERS 3.0 (patrz str. 11 podręcznika użytkownika).
- Sprawdź woltomierz cyfrowy Millicell® ERS 3.0 za pomocą adaptera weryfikacyjnego (patrz str. 22 w podręczniku użytkownika).
- Ustaw przełącznik MODE na Ohm i włącz przełącznik Power On.
- Zmień położenie elektrody tak, aby krótsza końcówka znajdowała się w wierzchołkowej części wiszącej wkładki do hodowli komórkowej Millicell®, a dłuższa końcówka znajdowała się w zewnętrznej studzience. Krótsza końcówka nie powinna stykać się z komórkami rosnącymi na membranie, a dłuższa końcówka powinna tylko dotykać dna zewnętrznej studzienki. Aby zapewnić stabilne i powtarzalne wyniki, upewnij się, że elektroda jest utrzymywana stabilnie pod kątem 90° do płytki i dna wkładki.
UWAGA: Jeśli wymagane jest płukanie między pomiarami, aby zapobiec przenoszeniu próbki, użyj pożywki do hodowli komórkowej zamiast wody destylowanej. - Zarejestruj rezystancję.
- Określ rezystancję ślepej próby poprzez dodanie pożywki lub roztworu elektrolitu do ślepej studzienki/wkładki do hodowli komórkowej (tj, wkładki do hodowli komórkowej bez komórek i pełnego podłoża do hodowli komórkowej).
- Pomiar oporności w pustej wkładce i użycie tej wartości jako poziomu oporności "zero" lub "tła". Aby uzyskać rzeczywistą oporność tkanki, należy odjąć odczyt oporności na pustym wkładzie od odczytu oporności na tkance (wkład hodowli komórkowej z komórkami).
- Oporność jest odwrotnie proporcjonalna do powierzchni tkanki. Im większa membrana, tym niższy opór.
Rezystancja powierzchni jednostkowej (Ω × cm2) = Rezystancja (Ω) × Efektywna powierzchnia membrany (cm2)
UWAGA: Rezystancja może się różnić w zależności od temperatury próbki, pH i głębokości elektrody w roztworze.
Notatki aplikacyjne, przewodniki i inne zasoby TEER
- Using Immortalized 16HBE14o- Human Bronchial Epithelial Cell Lines to Model Respiratory Lung Diseases
- Millicell® Cell Culture Inserts & Plates
- Lepszy sposób na TEER
- MultiScreen® Caco-2 Assay System
Protokół próby Lucifer Yellow Barrier Assay
Kroki
- Nasączyć pożywkę z apikalnej i basolateralnej strony membrany/dołka.
WSKAZÓWKA: Uważaj, aby nie dotykać ani nie szturchać membrany podczas aspiracji. - Umyj/płucz membranę i studzienkę podgrzanym Zrównoważonym roztworem soli Hanka (HBSS).
WSKAZÓWKA: Podgrzany HBSS ma najmniejszy wpływ na monowarstwę komórek; użycie PBS będzie bardziej szkodliwe i spowoduje większy procent przenikania barwnika. - Nasącz HBSS od strony wierzchołkowej i podstawno-bocznej membrany/ studzienki.
WSKAZÓWKA: Uważaj, aby nie dotykać ani nie szturchać membrany podczas aspiracji. - Dozuj 900 µL HBSS na podstawno-boczną stronę membrany.
- Dozuj 200 µL żółtego barwnika Lucifer (100 µg/mL) na apikalną stronę membrany.
WSKAZÓWKA: Bądź bardzo ostrożny, aby przypadkowo nie dodać żółtego barwnika Lucifer lub nie rozlać / nie kapać do przedziału podstawno-bocznego. Zakłóci to dokładność wyników testu. Nie nakłuwać membrany podczas pipetowania. - Umieścić w inkubatorze 37°C, 5% CO2 na 1 godzinę. Wydłużyć czas inkubacji do 2-3 godzin w przypadku membran o niskiej porowatości, takich jak przezroczyste wkłady Millicell® 0,4 µm (PCHT24H48).
WSKAZÓWKA: Aby uzyskać najlepsze wyniki, trzymaj płytkę płasko i nie wstrząsaj. - Wykorzystaj ten czas na wykonanie standardów dla płytki testowej, które identyfikują wartości próbki.
a.Stwórz 100% standard [Std(100)] łącząc:
200 µL żółtego barwnika Lucyfera (100 µg/ml) z 900 µL HBSS.
b.Rozcieńczyć wzorce 1:1 w seryjnym rozcieńczeniu.
500 µL Std(100) z 500 µL HBSS tworzy Std(50)
c. Najniższy standard (oprócz 100% HBSS) powinien zawierać 0,39% żółcieni lucyfera (dałoby to dziewięć standardów i dziesiąty dla HBSS
zero").
d.Dodaj 100 µL każdego standardu do płytki do spektroskopii fluorescencyjnej (w trzech egzemplarzach). - Wyjmij płytkę z inkubatora i zbierz 100 µL płynu z podstawno-bocznej strony membran, aby umieścić go na płytce do spektroskopii fluorescencyjnej.
WSKAZÓWKA: Aby uzyskać najlepsze wyniki, wykonaj tę czynność w trzech egzemplarzach, aby wyniki można było uśrednić jako powtórzenia techniczne. - Odczytaj płytkę spektroskopii fluorescencyjnej na czytniku płytek i określ absorbancję fluorescencji przy użyciu długości fali wzbudzenia 485 nm i emisji 535 nm.
- Użyj wygenerowanej krzywej standardowej do obliczenia stężenia żółcieni Lucyfera w każdym dołku. Wartości te można następnie wykorzystać do określenia procentowego przejścia dla każdej próbki.
RFU = relative fluorescence units przypisane przez czytnik płytek.


Rysunek 3. Wszystkie przedstawione membrany to 24-dołkowe membrany PET o wysokiej gęstości (1×108) i wielkości porów 0,4 µm. Wyniki te porównują wiszące wkładki do hodowli komórkowych Millicell® (PTHT24H48) do dwóch porównywalnych marek wkładek. Komórki MDCK zostały wysiane z taką samą gęstością wysiewu równolegle u wszystkich trzech producentów. Wkładki trzech marek nie różnią się znacząco od siebie w 7. dniu po wysianiu i mają podobną kinetykę tworzenia monowarstwy.

Rysunek 4. Testy przepuszczalności żółci lucyferowej testują tworzenie monowarstwy komórkowej i ścisłych połączeń między komórkami. Wszystkie przedstawione membrany to membrany PET o wysokiej gęstości (1 x 108 porów) i wielkości porów 0,4 µm w formacie 24-dołkowym. Wyniki te porównują wiszącą wkładkę do hodowli komórkowej Millicell® (PTHT24H48) z dwiema innymi markami wkładek. Test ten przeprowadzono w 7. dniu testu przedstawionego na Rysunku 3. Tworzenie bariery uważa się za udane, jeśli występuje mniej niż 5% przenikania barwnika z wierzchołkowej strony błony do podstawno-bocznej strony błony (przenikanie przedstawione w ostatnim panelu na Rysunku 1). Nie było różnic statystycznych między tymi wkładkami.

Rysunek 5. Wartości TEER zależą od początkowej gęstości wysiewu, która koreluje z konfluencją komórek na wiszącym wkładzie do hodowli komórkowej Millicell®. Wyższe gęstości wysiewu komórek szybciej utworzą monowarstwę komórkową. W zależności od eksperymentu, bardziej korzystne może być stosowanie wyższych lub niższych gęstości wysiewu, w zależności od celu badania. W powyższym przykładzie komórki MDCK zostały wysiane z tego samego materiału i zmierzono ich oporność we wskazanych dniach. Wszystkie pomiary wykonano na woltomierzu cyfrowym Millicell® ERS 3.0 z wiszącymi wkładkami do hodowli komórkowych Millicell® (PTHT24H48).
Barrier Assay Tips and Tricks
- Wybierz membranę, która najlepiej pasuje do typu komórek i testu (patrz Tabela 1& nbsp;powyżej) powyżej)
- Zmieniaj pożywkę co drugi dzień, aby zapewnić komórkom wystarczającą ilość składników odżywczych i utrzymać istotną sygnalizację komórkową dla tworzenia monowarstwy / ciasnego połączenia.
- Nie pozostawiaj komórek poza inkubatorem przez dłuższy czas przed testami. Może to negatywnie wpłynąć na wyniki testu przepuszczalności żółcieni Lucifera, a także innych podobnych testów.
- Upewnij się, że elektrody sondy TEER są całkowicie zanurzone w pożywce, aby uzyskać najbardziej stabilne odczyty.
- Przytrzymaj sondę TEER na tej samej głębokości w każdej studzience/wkładce, aby uzyskać spójne i porównywalne odczyty.
- Aby zapewnić stabilne i powtarzalne wyniki, upewnij się, że elektroda jest ustawiona pod kątem 90 ° do wkładki płytki.
- Odporność może się zmieniać wraz z temperaturą. Odczyty TEER wzrastają (wyższe omy Ω) w niższych temperaturach (niższe °C). Przed wykonaniem odczytów należy poczekać, aż próbki zaaklimatyzują się do temperatury pokojowej.
- Na odporność ma wpływ pH pożywki. Wyższa zawartość dwutlenku węgla będzie obecna w próbkach wyciągniętych bezpośrednio z inkubatora i jest związana z niższymi wartościami oporu. Ilość dwutlenku węgla zrównoważy się z atmosferycznym dwutlenkiem węgla podczas aklimatyzacji do temperatury pokojowej.
- Okresowo czyść elektrody TEER za pomocą detergentu enzymatycznego, takiego jak Tergazyme®, aby wyeliminować gromadzenie się białek na elektrodzie z mediów do hodowli komórkowych. Procedurę czyszczenia można znaleźć w Podręczniku użytkownika Millicell® ERS 3.0.
- Model Millicell® ERS 3.0 posiada kabel, który jest bardziej podatny na zakłócenia fal radiowych. Pochodzą one z telefonów komórkowych, laptopów, komputerów, sprzętu radiacyjnego (MRI, RTG itp.), a nawet inteligentnych zegarków. Rozważ przeniesienie obszaru testowego do obszaru o najmniejszej ilości tych zakłóceń.
- Nigdy nie umieszczaj woltomierza Millicell® ERS 3.0 lub jego sondy elektrodowej w świetle UV. Spowoduje to uszkodzenie czujnika elektrody i doprowadzi do niedokładnych, zmiennych lub niemożliwych do wykonania odczytów.
- Jeśli wymagane jest płukanie między pomiarami, aby zapobiec przenoszeniu próbek, należy używać pożywki do hodowli komórkowych, a nie wody destylowanej.
- Uważaj, aby nie dotykać ani nie szturchać membrany podczas zasysania.
- Podczas testu przepuszczalności żółcieni lucyferowej, wstępnie ogrzany HBSS ma najmniejszy wpływ na monowarstwę komórek; użycie PBS będzie bardziej szkodliwe i spowoduje większy procent przenikania barwnika.
- Bądź bardzo ostrożny, aby przypadkowo nie dodać żółcieni lucyferowej lub rozlać / kapać do przedziału podstawno-bocznego. Zakłóci to dokładność wyników testu. Nie szturchaj membrany podczas pipetowania.
- Po dodaniu żółtego barwnika Lucifer do membrany, aby uzyskać najlepsze wyniki, trzymaj płytkę płasko i nie wstrząsaj.
- Na koniec testu przepuszczalności żółtego barwnika Lucifer, zbierz ciecz podstawno-boczną po wymieszaniu (pipetą w górę iw dół), a następnie uruchom wyniki passthrough w technicznych triplikatach, aby uzyskać najlepszy wynik.
1 - 20
21 - 40
41 - 60
61 - 80
81 - 82
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?