Fontos dokumentumok
S1826
Sialic Acid Aldolase from Escherichia coli K12
recombinant, expressed in E. coli BL21, ≥3.0 units/mg protein
Szinonimák:
N-Acetylneuraminate lyase, N-Acetylneuraminate pyruvate-lyase (N-acetyl-D-mannosamine-forming)
About This Item
Javasolt termékek
rekombináns
expressed in E. coli BL21
Minőségi szint
Forma
lyophilized powder
specifikus aktivitás
≥3.0 units/mg protein
molekulatömeg
33.4 kDa
kiszállítva
dry ice
tárolási hőmérséklet
−20°C
Általános leírás
Alkalmazás
Egység definíció
Fizikai forma
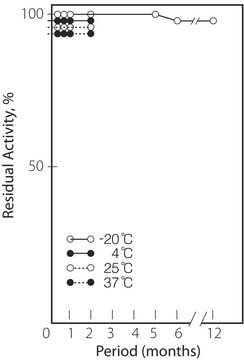
Analízis megjegyzés
Figyelmeztetés
Warning
Figyelmeztető mondatok
Óvintézkedésre vonatkozó mondatok
Veszélyességi osztályok
Eye Irrit. 2 - Skin Irrit. 2 - STOT SE 3
Tárolási osztály kódja
11 - Combustible Solids
WGK
WGK 3
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Válasszon a legfrissebb verziók közül:
Analitikai tanúsítványok (COA)
Nem találja a megfelelő verziót?
Ha egy adott verzióra van szüksége, a tétel- vagy cikkszám alapján rákereshet egy adott tanúsítványra.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Az ügyfelek ezeket is megtekintették
Cikkek
Understand sialic acid structure, function, signaling, and modifications. Easily find products for sialic acid research.
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással