05-1140
Anti-phospho-Focal Adhesion Kinase (Tyr397) Antibody, clone 18
clone 18, from mouse
Szinonimák:
FADK 1, PTK2 protein tyrosine kinase 2, Protein-tyrosine kinase 2, focal adhesion kinase 1
Méret kiválasztása
140 000,00 Ft
Méret kiválasztása
About This Item
140 000,00 Ft
Javasolt termékek
biológiai forrás
mouse
Minőségi szint
antitest forma
purified immunoglobulin
antitest terméktípus
primary antibodies
klón
18, monoclonal
faj reaktivitás
mouse, human
technika/technikák
western blot: suitable
izotípus
IgG1
UniProt elérési szám
kiszállítva
wet ice
célzott transzláció utáni módosítás
phosphorylation (pTyr397)
Géninformáció
human ... PTK2(5747)
mouse ... Ptk2(14083)
Általános leírás
Egyediség
Immunogén
Alkalmazás
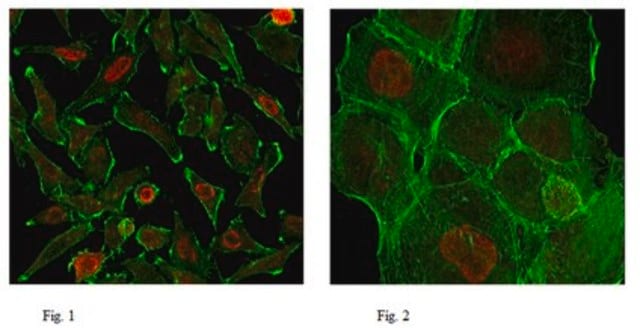
Cell Structure
Cytoskeletal Signaling
Minőség
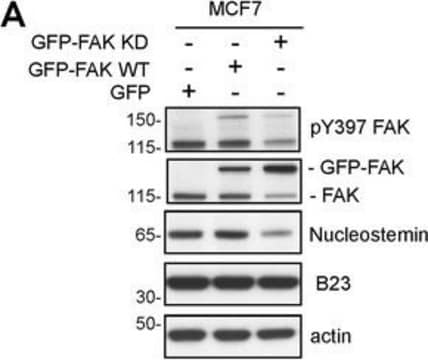
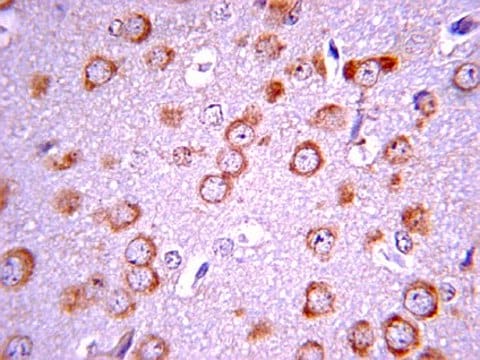
Western Blot Analysis: 1:500 dilution of this lot detected phospho-FAK (Tyr397) on 10 ug of LPS treated RAW 264 lysates.
Cél megnevezése
Kapcsolódás
Fizikai forma
Tárolás és stabilitás
Note: Variability in freezer temperatures below -20°C may cause glycerol containing solutions to become frozen during storage.
Analízis megjegyzés
LPS treated RAW 264 lysates.
Egyéb megjegyzések
Jogi nyilatkozat
Nem találja a megfelelő terméket?
Próbálja ki a Termékválasztó eszköz. eszközt
Tárolási osztály kódja
10 - Combustible liquids
WGK
WGK 2
Lobbanási pont (F)
Not applicable
Lobbanási pont (C)
Not applicable
Analitikai tanúsítványok (COA)
Analitikai tanúsítványok (COA) keresése a termék sarzs-/tételszámának megadásával. A sarzs- és tételszámok a termék címkéjén találhatók, a „Lot” vagy „Batch” szavak után.
Már rendelkezik ezzel a termékkel?
Az Ön által nemrégiben megvásárolt termékekre vonatkozó dokumentumokat a Dokumentumtárban találja.
Active Filters
Tudóscsoportunk valamennyi kutatási területen rendelkezik tapasztalattal, beleértve az élettudományt, az anyagtudományt, a kémiai szintézist, a kromatográfiát, az analitikát és még sok más területet.
Lépjen kapcsolatba a szaktanácsadással