導言
體細胞可透過表達四種轉錄因子(Oct-4、Klf-4、Sox-2和c-Myc)轉化為誘導多能幹(iPS)細胞的發現,為幹細胞研究開創了一個令人振奮的新領域1。許多以前缺乏全面體外細胞模型的人類疾病,現在都可以使用源自患者的iPS細胞來建模。神經系統疾病,如阿爾茨海默氏病、帕金森氏病和自閉症,是一些最早使用iPS細胞方法建模的疾病。源自 iPS 細胞的高濃縮和可擴展神經祖細胞 (NPC) 是生物醫學研究中,組織分離原代細胞和永生化神經幹細胞系的吸引人的替代品。這些iPS細胞衍生的NPCs提供了一個令人興奮的機會來研究神經元的發育和特定神經細胞類型的承諾,而沒有與使用人類胚胎幹細胞相關的倫理問題。
雙SMAD抑制是從人類ES和iPS細胞衍生神經祖細胞的成熟方法2。本方案使用兩種 SMAD 抑制劑 Noggin 和 SB431542 來驅動 ES/iPS 細胞快速分化為高度豐富的 NPCs2。Noggin 可作為 BMP 抑制劑,而 SB431542 則透過阻斷 ALK4、ALK5 和 ALK7 受體的磷酸化來抑制 Lefty/Activin/TGFβ 通路。為了做出更明確、更優化的神經元分化方案,Li 及其同事修改了原始方案,建立了完全以小分子為基礎的分化方法,該方法依賴三種小分子抑制 GSK-3β (CHIR99021)、TGFβ (SB431542) 和 Notch (化合物 E) 訊號通路,以及人類 LIF3。這種新的以小分子為基礎的神經分化方案增加了神經分化動力學,允許衍生出真正多能的神經幹細胞,對指定前腦、中腦和後腦神經和膠質亞型的區域模式化線索作出反應。
結合上述方法,我們開發了一種新的神經元誘導培養基(NIM)和神經元分化培養基(NDM),從人類ES/iPS細胞中有效地製造神經輪、可擴展神經祖、末期神經(谷氨酸能和多巴胺能)和膠質亞型(少突胶质细胞)。這些培養基依靠常用的神經補充劑與小分子抑制劑組合的組合來獲得高度豐富的多能 NPCs。許多報告都顯示 NPC 的分化傾向於單一品系,主要是神經元或膠質,而非兩者皆是。使用我們新開發的 NIM 和 NDM 培養基,iPS 細胞衍生的 NPC 群體對適當的誘導模式化信號反應良好,並可定向於神經和膠質細胞系。

圖 1.顯示 iPS 細胞生成及隨後分化為神經和膠質系的所有步驟的工作流程。只需四個步驟,成人成纖維母細胞就能轉化為神經系和膠質系,並使用調節細胞命運的培養基配方。
使用神經誘導培養基分化 iPSCs 的神經元
iPS細胞衍生的神經祖細胞和分化的神經元細胞是使用人類 ES/iPS
Cell Neurogenesis kit(SR603)。將未分化的 iPS 細胞菌落接種到 MEFs MEFs 48 小時,使用 20% KOSR 培養基,輔以 FGF-2,8 ng/mL(F0291)。48 小時後,生長培養基更換為神經誘導培養基 1 (NIM1),持續五天,每隔一天更換一次培養基。第六天,用非酶緩衝液 (S-004-C) 解離細胞,然後將細胞培養在 0.5 mg/mL Matrigel® 板上,再用神經誘導培養基 2 (NIM2) 培養五天,每隔一天更換一次培養基。10天後,用Accutase® 試劑(SCM004)补充20 ng/mL FGF-2和2 mM谷氨酰胺在烧瓶或平板上涂布0.1 至 0.2 mg/mL 的 Matrigel® ,密度為 0.5 至 1 x 105 細胞/平方厘米。
神經祖細胞分化成神經元
用Accutase® 試劑(A6964)採集P3至P8的神經祖細胞。/a>),並將 NPCs 複製於聚 L-鸟氨酸/氨基甲酸乙酯,各 10 μg/mL (P4957; SCM111),並補充 0.5 mM 二丁酰 cAMP 和 0.2 mM 抗壞血酸磷酸酯。約 80% 的培養基每兩到三天更新一次,共 9-14 天。免疫螢光染色前用 2% 多聚甲醛固定細胞。分化細胞的百分比由目測決定。
SCR128)併入基於 NIM 的神經發育方案中。在 NIM2 培養液中加入 200 ng/mL 的聲刺猬和 100 ng/mL 的 FGF-8,並將細胞培養五天。然後用Accutase® 試劑將細胞收成單細胞,並將3 x 104 .NPCs接種到聚乙烯薄膜上;NPCs分別以10 μg/mL與含20 ng/mL BDNF和GDNF及1 ng/mL TGFβIII的神經元分化培養基,接種於poly-L-ornithine-和laminin-coated平板上14天。代表多巴胺能神經元的酪氨酸羥化酶陽性細胞經由免疫螢光染色定性。
神經祖細胞分化成少突胶质細胞
iPS細胞的少突胶质分化是在P1時用少突胶质細胞擴展培養基(SCM107、含 PDGF-AA、NT3、FGF2、T3 的基礎培養基)和視黃酸培養 14 天。然後將膠質命運引導的神經球,以每顆 10 μg/mL 的量,接種在塗有 poly-L-ornithine 和 laminin 的接種板上,以人類 OPC 自發分化培養基 (SCM106)進一步成熟 14 天,每兩到三天更換一次培養基。
神經元祖細胞的區域特異性模式化
iPS 細胞按照 NIM 使用指南中的描述誘導至神經元系。第 5 天,將細胞在 NIM2(用於自發分化)、含有 200 ng/mL sonic hedgehog 和 100 ng/mL FGF8(SHH/FGF8;用於促進細胞向中腦轉化)或 200 ng/mL sonic hedgehog 和 1 μM retinoic acid(SHH/RA;用於促進細胞向後腦轉化)的 NIM2 中再培養 10 天。10 天後收穫細胞,以 qRT-PCR 分析基因表達模式。GAPDH 用來規範樣本間的基因表達。基因表達的 Fold 變化是根據 ΔCt 值(歸一於 GAPDH)計算,並歸一於自發性樣本(自發,n = 2)。
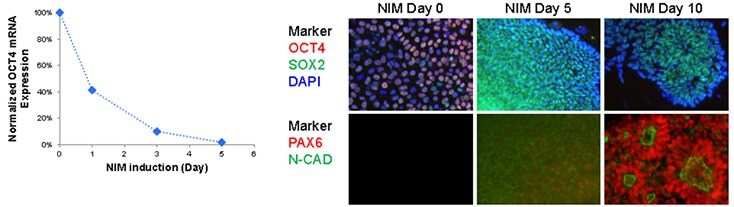
圖 2.iPSCs 的神經元分化 A) 在 NIM 方案中多能製造器 OCT4 的快速下調。早在神經誘導後 24 小時,Oct4 表達就被大幅下調。B) 在 NIM 協議中,神經製造者上調。Oct4 表達在 NIM 5 天後減少,而 Sox2 表達在神經誘導過程中呈現中度增加。神經標誌物 PAX6 和 N-cadherin 在 10 天後上調,形成極化的神經花冠結構。

圖 3.iPSC 衍生神經祖細胞的特性。使用 NIM 從 iPS 細胞衍生的第 3 期 NPC 顯示典型的神經祖細胞形態 (A),並對 NPC 標誌 Sox-2、N-cadherin (B)、Pax6 和 Nestin (C) 進行染色。這些細胞可擴展 10 個傳代,同時維持 Nestin 和 Sox-2 的表達。
使用神經元分化培養基(Neuronal Differentiation Medium,NDM)將iPS細胞衍生的神經祖細胞進一步分化成終期分化的神經元。超過70%的分化細胞對成熟神經元的標誌物TUJ1和MAP2呈陽性反應,而不到20%的分化細胞對星形細胞的標誌物GFAP呈陽性反應。使用 NDM,終期分化的神經元細胞優先是谷氨酰胺能(VGlut+)神經元,而不是 GABA 能神經元(GAD65 -)。

圖 4.iPSC 衍生 NPC 的神經元分化。經過 9 天的分化後,細胞顯示出延伸且精細的神經細胞網路。大部分分化的細胞表達神經元標誌物 TUJ1 和 MAP2 (A),部分細胞分化為 GFAP+ 星形細胞。(B).末期分化的細胞主要是谷氨酰胺能(C)而非 GABA 能神經細胞(D)。
SCR128; SHH、FGF8、BDNF、GDNF 和 TGFβIII)組合,ES 和 iPS 細胞衍生的神經祖先都可以定向分化為酪氨酸羥化酶陽性的多巴胺能神經細胞。分化 14 天後,10-30% 的分化培養物呈現酪氨酸羥化酵素陽性。
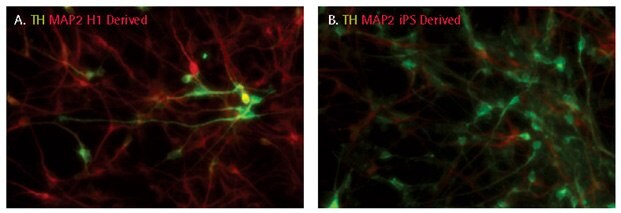
圖 5.iPSC 衍生 NPC 的多巴胺能分化。分化 14 天後,多巴胺能神經元的特徵是追蹤酪氨酸羥化酶(TH)的表現。10-30%的細胞對酪氨酸羥化酶呈陽性反應。
使用專利的少突胶质细胞分化方案,人iPS细胞衍生的NPC可以有效地分化成胶质系。分化出的細胞群中,少突膠質細胞標誌物 A2B5、O4 和 Sox10 陽性佔 80%,GFAP 陽性佔 10%,GalC 陽性佔 30%。

圖 6.iPS細胞衍生NPC的少突胶质细胞分化。將細胞在少突胶质细胞扩增培养基和小分子培养基中培养成神经球 14 天后,移植到聚 L-鸟氨酸和层粘连蛋白包被的平板上,进行 A2B5 (A)、O4 (B)、Sox10 (C)、TUJ1 和 GFAP (D)、NG2、GalC (E)、Sox-2 和 Nestin (F) 的免疫细胞化学分析。超過 80% 的細胞為 A2B5、O4 或 Sox10 陽性,10% 為 GFAP 陽性,30% 為 GalC 陽性。
使用NDM和特定的模式化誘導劑(SHH/FGF8或SHH/視黃酸)可將人iPS細胞衍生的NPC模式化為中腦、前腦或後腦神經元。使用 qRTPCR 測量區域特異性標誌物的表達來判斷模式化是否成功。

圖 7.NPC 神經元分化的區域特異性模式化。STEMCAA™ 衍生的 iPS 細胞按所述方法誘導至神經系。在第 5 天,將細胞培養在 NIM2 (自發性),或含有 200 ng/mL sonic hedgehog、100 ng/mL FGF8 (SHH/FGF8) 或 200 ng/mL sonic hedgehog、1μM retinoic acid (SHH/RA) 的 NIM2 中 10 天,以分別為中腦和後腦培養細胞。10 天後,收穫細胞並透過 qRT-PCR 分析基因表達模式。
結論
我們已經開發出一種高效的新神經誘導和分化培養基,用來從 iPS 細胞生成高度可擴展和多能的神經祖細胞以及末期神經元和膠質細胞。這些培養基使用既有的小分子抑制劑和神經培養基添加劑,以產生快速的分化動力和效率。我們顯示 iPS 細胞衍生的 NPCs 可擴大至 10 個傳代,同時維持適當的生長動力學和標誌物表達。這些 NPCs 具有多能性,可根據培養條件中引入的環境因素分化為神經元、星形細胞和少突細胞。使用常用的生長因子誘導劑,也可以從 NPCs 產生特定的神經亞型,例如 TH+ 多巴胺能神經元和 VGlut+ 谷氨酸能神經元。這些培養基提供了完整的解決方案,讓研究人員使用 iPS 細胞模型系統來建立神經系統疾病的模型,例如阿茲海默症、帕金森氏症和自閉症。
材料
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?