利用醛脫氫酶 (ALDH) 紅移螢光活細胞探針 AldeRed™ 588-A 檢測癌症幹細胞。
Nick Asbrock1, Konstantin Taganov1, Vi Chu1, Martin G. Pomper2, Il Minn2, Haofan Wang2, Steven D. Leach2
1Assay & Platform Development, Bioscience BU, MilliporeSigma, 28820 Single Oak Drive, Temecula, CA, USA 9259, 2Johns Hopkins Russel H. Morgan Department of Radiology and Radiological Science, Baltimore, Maryland 21287, USA.
引言
癌症幹細胞(CSCs)是癌症細胞的亞群,可以自我更新,在腫瘤腫塊中產生多樣化的細胞,並維持腫瘤的生成。有些研究人員認為,癌症是由癌症幹細胞引起的,而癌症幹細胞是正常幹細胞突變的結果。高 ALDH 活性可作為正常與惡性幹細胞的通用標記。細胞可根據 ALDH 的酵素活性進行識別與分離,ALDH 是一種解毒酵素,負責氧化有害的醛副產物。ALDH 標記已被用來分離各種人類惡性腫瘤的癌症幹細胞,包括膀胱、乳腺、頸椎、結腸、頭頸、肝臟、肺、胰臟、前列腺和卵巢。
AldeRed™ ALDH 檢測套件為癌症和幹細胞科學家提供了活細胞分離和表徵的新功能。AldeRed™ 試劑是醛脫氫酶 (ALDH) 的紅移螢光底物,可利用流式細胞計識別和分離癌症幹細胞,同時使用綠色螢光細胞系、抗體、轉基因動物和報告器檢測。
Pomper MG et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase.Nat Commun.2014 Apr 23;5:3662.
。
圖 1. AldeRed™ 作用機制。AldeRed™ 588-A 是一種螢光且無毒性的 ALDH 底物,可自由擴散至完整且有活力的細胞中,但一旦被 ALDH 轉換為相對應的酸,就會滯留在細胞內。所產生的螢光量與細胞中的 ALDH 活性成正比,並可透過流式細胞計測量,從而進行螢光活化細胞分選 (FACS)。為了使 AldeRed™ 588-A 得到最佳的激發與發射效果,請使用藍色雷射 (488 nm) 或綠色雷射 (532 nm) 與 PE-Texas Red 探測器 (615 nm) 的組合。
方法
使用 AldeRed™ 流式細胞計檢測癌症幹細胞群588-A
A) 試劑製備
AldeRed™ 分析緩衝液的準備
- 從試劑盒提供的四個瓶子中取出 1 mL AldeRed™ 分析緩衝液,並將其加入含有維拉帕米粉末的四個小瓶中的一個。攪拌小瓶 2-3 分鐘,將溶液移回同一瓶 AldeRed™ 分析緩衝液中。
重要提示: AldeRed™ Assay Buffer 需要補充外流抑制劑 Verapamil,以防止 AldeRed™ 588-A 反應產物外流和螢光損失。
注意: 添加了 Verapamil 的 AldeRed™ 分析緩衝液可在 2-8 °C 下儲存 3 個月。
AldeRed™ 588-A 的製備
- 讓所有試劑平衡至室溫。
- 加入 25 μL DMSO 至小瓶乾 AldeRed™ 試劑中,混勻。
- 加入 25 μL 2N HCl,混勻。在室溫下培養 15 分鐘。
- 加入 360 μL AldeRed™ Assay Buffer(添加 Verapamil)並混勻。
- 使用過程中,將 AldeRed 588-A 保存於 2-8 °C。
註: 分離剩餘的 AldeRed™ 588-A,並保存於 -20 °C 黑暗處。避免重複凍融循環。
- 根據您使用的細胞類型(黏附、懸浮、新鮮或冷凍),按照標準程序將細胞懸浮在生長媒體中並進行計數。調整細胞數量,將細胞沉澱,然後用 1 mL 補充了 Verapamil 的 AldeRed™ 分析緩衝液取代生長培養基。
注意: 每種細胞類型的細胞濃度可能需要優化(例如 SK-BR-3 細胞的最佳濃度為 1- 2x105 cells/mL, 圖 2)。建議測試一定範圍的細胞濃度,以確定最高的信號與背景比率(即測試樣本對 DEAB 處理的對照樣本)。
- 為每個待測細胞樣本標示一個「測試」和一個「對照」1.5 mL 微離心管。將步驟 B 中的 1 mL 細胞懸液移至對應的 「測試 」管中。
- 在每個 「對照 」管中加入 5 μL DEAB 試劑。重新蓋上 「對照 」管和 DEAB 瓶以防止乙醇蒸發。
- 將步驟 A.5 中製備的 AldeRed™ 588-A 5 μL 加入含有 1 mL 細胞懸液的 「測試 」管中。
- 對每個待檢樣品重覆步驟 C.2-3。
- 將 「測試 」管和 「對照 」管在 37 °C 孵育 30-60 分鐘。不同類型的細胞可能需要最佳化的確切培養時間。
- 將所有試管以 250 x g 離心 5 分鐘,並棄掉上清液。將細胞顆粒重懸於 0.5 mL AldeRed™ Assay Buffer(添加維拉帕米)中,並將細胞置於冰上以防止 ALDH 反應產物外流。
- 可選: 此時可使用針對細胞表面標誌物的螢光抗體對完整細胞進行免疫分型,同時將細胞保持在添加了維拉帕米的 AldeRed™ 分析緩衝液中,冰敷以防止 AldeRed™ 反應產物外流。
注意: 為了使 AldeRed™ 588-A 得到最佳的激發和發射,請使用藍色雷射 (488 nm) 或綠色雷射 (532 nm) 與 PE-Texas Red 探測器 (615 nm) 的組合。也可以在近端測量通道(如 PE)進行檢測,但可能會影響測試樣本與 DEAB 處理對照樣本之間的 delta MFI(平均螢光強度)。
- 根據流式細胞儀的廠牌和型號,工作流程可能會有所不同。
- 在設置模式下,使用 DEAB 「對照 」樣品調整 FSC 和 SSC 電壓和增益,並創建包含有核細胞的區域 (R1)。
- 在 R1 上創建 AldeRed™ 588-A vs. SSC 點陣圖,並調整電壓,使 DEAB 「對照 」樣品細胞群的右側邊緣位於 X 軸上的第二個刻度。
- 運行相應的「測試」樣本,並建立包含 ALDHHi 細胞的區域 R2(圖 2 和 3)。
- 將流式細胞儀切換到樣本擷取模式,並收集所有「對照」和「測試」樣本的資料。
結果
。
圖 2. ALDEFLUOR™ 和 AldeRed™ 可識別相似的 CSC 群。使用藍光雷射 (488 奈米) 與 FITC 檢測 (525 奈米) 組合,使用 ALDEFLUOR™ 檢測 SKBR3 細胞中的 ALDH,得到 91% 的 ALDHhi 細胞群。使用綠色雷射 (532 奈米) 與 PE-Texas 紅檢測器 (615 奈米) 組合,以 AldeRed™ 分析法檢測 SKBR3 細胞中的 ALDH,可得到 92% 的 ALDHhi 細胞。

圖 3. AldeRed™ 可與 FITC 結合抗體共同標示 CSC 群。用 AldeRed™ 588-A 和 Milli-Mark™ EpCam-FITC 抗體 (克隆 mAB8 Cat No. FCMAB264F) 共同標示 SK-BR-3 細胞,可得到 54% 的 ALDHhiEpCAMhi。
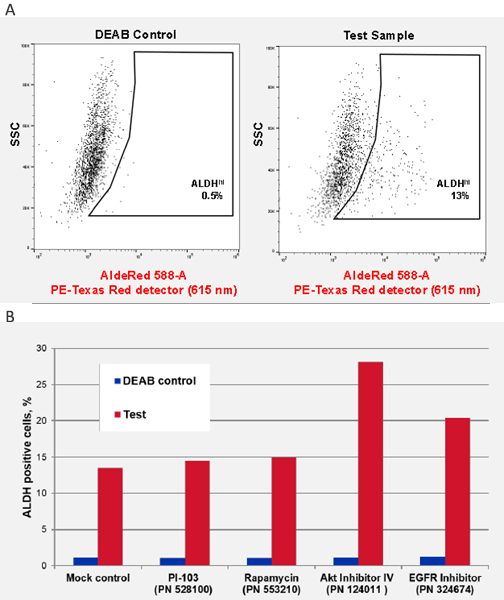
圖 4. 頭頸部鱗狀癌細胞株的 ALDH CSC 鑑定。UM-SCC-47 是從原發性腫瘤中分離出來的獨特頭頸鱗狀癌細胞株,含有整合的人類乳突病毒 (HPV-16),其特徵是存在 ALDH+ 癌症幹細胞亞群。A) 利用 AldeRed™ 588-A 檢測 UM-SCC-47 癌細胞株中的 ALDH,得到 13% 的 ALDHhi CSC 群。B) 信號通路抑制劑對 ALDHHi CSC 群的影響。用每種抑制劑 1 uM 處理 UM-SCC-47 細胞 24 小時,並以 AldeRed™ 588-A 測量 ALDH 活性。值得注意的是,AKT 抑制劑 IV (124011) 和 EGFR 抑制劑 (324674) 增加了整體 ALDH 陽性的 CSC 群。

圖 5. 用 ALDEFLUOR™ 和 AldeRed™ 588-A 共染色的 CA/TD 小鼠胰腺細胞的共焦圖像。
商標
ALDEFLUOR™ 是 Aldagen Inc.的註冊商標。
AldeRed™ 是 Merck KGaA, Darmstadt, Germany 和/或其附屬公司的商標。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?