
圖 1.3D 多能幹細胞
Introduction
本白皮書說明了三維 (3D) 細胞培養在生產多能性幹細胞 (PSC) 衍生的胚胎發育和分化模型中的重要性。白皮書包含類胚體 (EB) 的一般概述,以及用於產生類胚體的各種方法的比較。此外,還討論了使用畸胎瘤實驗與 EB 來驗證新衍生的 PSC 種系的多能性。最後,還簡要描述了最近發表的文章,說明如何使用 3D 培養來最大化分化。
生成类胚胎体
类胚胎体(EB)是类似胚胎的 PSC 三维聚集体,这意味着它们包含来自所有三个胚层(外胚层、内胚层和中胚层)的细胞。EB 分化的初始階段與植入後早期胚胎的分化非常相似1。
EB中首先分化的細胞類型是原始內胚層的外層,而原始內胚層又會分泌基底膜。
分泌的細胞外基質包圍著原始外胚層細胞的內部,而原始外胚層細胞相當於胚胎的上胚層。未與基底膜接觸的原始外胚層細胞會發生凋亡,形成囊狀結構。在胚胎中,胚外信號中心在上胚層中為原始條紋創造一個精確的位置,在此開始胃形成,進而形成中胚層和內胚層。然而,EB 缺乏胚外信號中心,因此與胚胎相比,中胚層和內胚層從原始外胚層分化出來的過程被視為混亂無序的。有兩個研究小組提出,EBs 內部的組織比之前所猜測的要多;當 EBs 在適當的時間得到適當的信號時,它們的組織可以大幅改善,進而接近正常的胚胎學過程,例如胃形成2, 3。這些特性使 EB 成為一個極佳的模型系統,可用來研究胚胎發育過程中原本無法進入的時期,尤其是使用人類來源的細胞時4, 5。
目前有許多不同的方法可用來產生 EB,其中一些方法如圖 2所示。所有這些方法最重要的特徵是抑制造血干細胞黏附到表面,從而促進E-cadherin依賴的相互黏附。

圖 2.用於產生類胚體的許多方法中的一些。
細菌級平皿(靜態)、旋轉瓶和慢轉器等懸浮培養器的設置和維護都很簡單,但它們會產生不同大小的 EB,這些 EB 會聚結成各種不同的形狀(圖 3)。EB 大小的增加會導致質量傳輸率降低7。此外,眾所周知,EB大小和形狀的改變都會改變分化模式8。此外,一旦原始內胚層開始分泌細胞外基質,EB 就會隨機開始黏附,甚至黏附在細菌培養皿的疏水性表面上,導致黏附和漂浮的 EB 之間的品系規格出現巨大差異。旋轉瓶(spinner flasks)和緩慢轉動的容器可以減少聚集並防止前面提到的表面黏附,但這必須與剪切力造成的細胞損傷相平衡9。強制聚集培養,如圓底低黏附板、離心管和工程微孔盤(圖 2中未顯示),可以精確控制由每孔加入的細胞數決定的 EB 大小。

圖 3.來自慢速轉動容器 (A)、懸滴培養 (B) 和細菌級平皿中靜態懸浮培養 (C) 的 EB 影像。請注意,懸滴培養的 EB 大小和形狀最為均勻。圖片改編自9。比例尺 = 500 μM
在微孔和管中強制聚集的一個缺點是,通過與堅硬的人工塑料屏障接觸來人為地支配和限制 EB 的形狀會改變分化10。要從小孔和小管中移除 EB 而不破壞其結構也非常困難。圖 2所示的最有利的方法是懸滴培養。接種細胞的數量控制懸滴EB的大小,EB的形狀在任何時候都不會受到任何人工塑料基底的限制或表面與任何人工塑料基底接觸。在過去,建立這些培養物是非常費力且困難的,因為這些培養物是在平板的蓋子上形成的,然後必須倒置平板才能懸掛液滴。
Perfecta3D® 懸掛液滴板大大改善了 EB 生成和後續培養的過程。將一滴細胞懸液滴入每個孔的頂部,平板的幾何形狀會使細胞和培養基穿過一個孔,形成一個穩定的懸滴。每個孔頂端的通孔可讓您交換培養基、加入外源細胞外基質、生長因子、小分子或其他細胞以建立共培養。所有這些選項都意味著 EB 如何分化具有極大的靈活性和控制力。能夠輕易餵養培養物,意味著它們可以像懸掛的液滴一樣維持更長的時間,避免結塊或粘在培養皿底部。

圖 4.Perfecta3D 掛盤
欲了解更多關於 3D 細胞培養的資訊,以及購買 Perfecta3D® 吊滴板,請造訪: http://3dbiomatrix.com
驗證多能性
當新的 PSC 株系被衍生出來時,必須對它們進行評估,以確認它們是真正的多能性。傳統上,對於人類 PSC 株系來說,這是透過體外 多能性基因的表達、表觀遺傳分析和 EB 形成檢驗,以及體內畸胎瘤檢驗(圖 5)來完成的。用小鼠 PSC 株系建立的四倍体互补11, 12 或注射到宿主囊胚13, 14等更嚴格的多能性測試,都無法在人類 PSC 株系上道德地進行。有些科學家強烈認為畸胎瘤檢測是人類 PSC 的最佳檢測方法,也是宣告新品系為多能性的絕對必要方法。然而,畸胎瘤檢測的方式存在極大的差異,因此人們對於建立更統一的程序有強烈的興趣,以便對新衍生的 PSC 株系的結果進行更多的比較15。

圖 5.腎囊下注射 PSC 所產生的整個畸胎瘤 (A)。含中胚(B、C)、內胚(D)和外胚(E、F)的蘇木精和伊紅染色畸胎瘤檢測切片影像。圖片來自16。縮放條 = 100 μM。
由於誘導多能幹細胞(iPSC)品系的生成速度遠高於胚胎幹細胞品系,當畸胎瘤試驗被視為關鍵時,這項試驗是一項日益繁瑣、昂貴和耗時的任務,需要大量的實驗動物。因此,在決定畸胎瘤試驗是否絕對有必要證明多能性,或一組 體外 試驗是否足夠之前,有幾個因素需要考慮。
標準化的 體外 EB形成導致一致的大小和細胞數量,再加上可量化的品系分析,在許多情況下是畸胎瘤實驗的有效替代方法(圖 6)17。例如,由於 iPSCs 的生物學和功能仍在仔細研究中,許多實驗室為了追求人類疾病模型而產生品系。用來做疾病模型的實驗室細胞系幾乎不需要確定其腫瘤屬性,因此花時間和金錢做畸胎瘤檢驗可能會被視為浪費時間和資源18。關於 iPSCs 是否能產生更優異的模型的爭論超出了本白皮書的範圍,也是有爭議的議題19-21。此外,在特定細胞類型或組織的胚胎發育非常清楚的情況下,定向 3D 分化(在下一節討論)可用於評估新的 PSC 株系參與「正常」發育模型的能力,這是畸胎瘤實驗或自發 EB 分化所無法證明的品質22.
。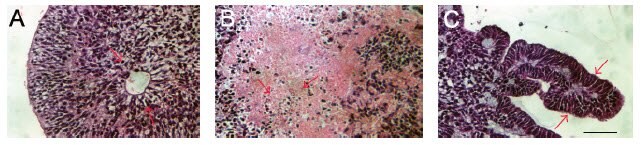
圖 6.用蘇木精和伊紅染色的EB切片,說明分化成外胚層(A)、中胚層(B)和內胚層(C)。
最大化分化
某些細胞類型和組織始終需要進行 3D 培養,以最大化其從 PSCs 的分化。胚胎發育並非發生在單層中,有無數的例子顯示來自一個胚層的細胞外訊號如何影響鄰近胚層的規格。例如,心臟的規格化發生在中胚層的細胞中,這些細胞會接觸到來自上覆的前內胚層的訊號23。事實上,與二維培養相比,三維培養可改善人類造血幹細胞的心臟分化,這可能是由於更多的生理信號、造血幹細胞衍生的心臟支援細胞的存在,以及心肌整體更自然的三維結構24, 25。在胚胎發育過程中,有一些表面外胚層區域會先增厚,然後形成感官器官的一部分,例如眼睛(視胎盤)和耳朵(耳胎盤)。這些區域的分化也需要多層結構,而這些結構根本無法在 2D 培養中產生。胚胎分化的複雜模式是無限的,透過 3D 培養可以更好地在體外複製 。事實上,有一些令人驚訝的例子顯示,從精確引導的 EB 分化成內耳毛細胞(圖 7)和視網膜色素上皮細胞26-28的自我模式分化感覺胎座。

圖 7.圖表簡化說明 PSCs 分化為耳胎座,然後再分化為感官上皮的 3D 分化過程28。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?