Test enzymatyczny α-amylazy (EC 3.2.1.1)
Przegląd: Oznaczanie aktywności alfa-amylazy
Tę procedurę można stosować do oznaczania aktywności α-amylazy.
Spektrofotometryczne oznaczanie reakcji zatrzymania (A540, droga światła = 1 cm) opiera się na następującej reakcji:

Definicja jednostki: Jedna jednostka uwalnia 1,0 mg maltozy ze skrobi w ciągu 3 minut przy pH 6,9 i temperaturze 20 °C.
Wymagane odczynniki i sprzęt
Fosforan sodu, jednozasadowy, numer produktu S0751
Chlorek sodu, numer produktu S9888
Skrobia ziemniaczana, numer produktu S2004
Wodorotlenek sodu, numer produktu S5881<
Winian sodowo-potasowy, tetrahydrat, numer produktu S2377.
Kwas 3,5-dinitrosalicylowy, numer produktu D0550
D-(+)-Maltoza, monohydrat, numer produktu M9171
Środki ostrożności
W celu uzyskania informacji dotyczących zagrożeń i bezpiecznego postępowania należy zapoznać się z kartą charakterystyki.
Instrukcje przygotowania
Do przygotowania odczynników należy używać ultraczystej wody (oporność ≥18 MΩ×cm w 25 °C).
Roztwór buforowy (20 mM fosforan sodu z 6.7 mM chlorku sodu, pH 6,9 w temperaturze 20 °C) - Przygotuj roztwór zawierający 2,4 mg/ml jednozasadowego fosforanu sodu o numerze produktu S0751 i 0,39 mg/ml chlorku sodu.39 mg/ml chlorku sodu, numer produktu S9888, w ultraczystej wodzie. Dostosuj do pH 6,9 w 20 °C przy użyciu 1 M NaOH/1 M HCl.
Roztwór skrobi [1.0% (w/v) Rozpuszczalny roztwór skrobi] - Przygotuj roztwór o stężeniu 10 mg/ml używając skrobi ziemniaczanej, numer produktu S2004, w buforze:
- Roztwór rozpuścić przez gotowanie na płytce grzewczej/mieszanie przez 15 minut z mieszaniem.
- Zdjąć z ognia. Kontynuuj mieszanie roztworu i pozwól mu ostygnąć do temperatury pokojowej.
- Doprowadź roztwór do końcowej objętości za pomocą ultraczystej wody.
- Kontynuuj mieszanie roztworu podczas całej procedury testu.
2 M roztwór wodorotlenku sodu (NaOH) - Przygotuj roztwór o stężeniu 80 mg/mL przy użyciu wodorotlenku sodu, numer produktu S5881, w ultraczystej wodzie.
5.3 M roztwór winianu sodowo-potasowego, tetrahydrat - Przygotować 1,496 mg/ml roztwór winianu sodowo-potasowego, tetrahydrat, numer produktu S2377, w 2 M roztworze wodorotlenku sodu (NaOH).Nie podgrzewać do wrzenia!
96 mM roztwór kwasu 3,5-dinitrosalicylowego - Przygotować roztwór o stężeniu 21.9 mg/ml roztworu przy użyciu kwasu 3,5-dinitrosalicylowego, numer produktu D0550, w ultraczystej wodzie. Rozpuścić substancje stałe przez ogrzewanie na płytce grzejnej/mieszanie. Nie podgrzewać do wrzenia!
Roztwór odczynnika barwnego - Do przygotowania 40 ml, dodaj:
- 12.0 ml ciepłej (50-70 °C) ultraczystej wody do odpowiedniej wielkości bursztynowej butelki.
Mieszając, powoli dodaj: - 8,0 ml ciepłego 5.3 M tetrahydratu winianu sodowo-potasowego
- 20 mL ciepłego 96 mM roztworu kwasu 3,5-dinitrosalicylowego
Roztwór jest stabilny przez 6 miesięcy w temperaturze otoczenia, jeśli jest chroniony przed światłem. Przygotowana objętość może być dostosowana w razie potrzeby.
0,2% (w/v) Maltose Standard - Przygotuj roztwór 2 mg / ml w kolbie miarowej przy użyciu monohydratu D-(+)-maltozy, numer produktu M9171, w ultraczystej wodzie.
α-Amylaza Roztwór próbki - Bezpośrednio przed użyciem przygotować roztwór zawierający 0.75-1,5 jednostek/ml α-amylazy w wodzie ultraczystej o temperaturze 20 °C.
Procedura
Ostateczne stężenie testu - W 2.00 ml objętości reakcyjnej, końcowe stężenie wynosi 0,50% (w/v) skrobi i ~1 jednostka α-amylazy.
1. Test próbki α-amylazy
a. Odmierzyć pipetą (w ml) następujące odczynniki do odpowiednich pojemników:
b. Wymieszać przez wirowanie i wyrównać do 20 °C. Następnie dodać (w ml):
c. Wymieszać przez wirowanie i inkubować przez dokładnie 3,0 minuty w temperaturze 20 °C. Następnie dodać:
d. Przykryć pojemniki wentylowaną pokrywką i umieścić we wrzącej łaźni wodnej na dokładnie 15 minut.
e. Wyjmij pojemniki z wrzącej łaźni wodnej. Następnie dodać (w ml):
e.
f. Schłodzić roztwory na lodzie do temperatury pokojowej.
g. Następnie dodać (w ml):
h. Wymieszać przez odwrócenie. Wyzerować odpowiedni spektrofotometr względem powietrza przy długości fali 540 nm i zapisać wartość A540 dla Próbki i Próbki ślepej.
2. Przygotowanie krzywej wzorcowej
a. Przygotuj krzywą standardową, pipetując (w mL) następujące odczynniki do odpowiednich pojemników:
Uwaga: W razie potrzeby można dodać dodatkowe standardowe poziomy.
b. Przykryj pojemniki wentylowaną pokrywką i umieść we wrzącej łaźni wodnej na dokładnie 15 minut.
c. Wyjąć pojemniki z wrzącej łaźni wodnej. Schłodzić roztwory na lodzie do temperatury pokojowej.
d. Następnie dodać (w ml):
e. Wymieszać przez odwrócenie. Zaślepić odpowiedni spektrofotometr względem powietrza przy długości fali 540 nm i zanotować wartość A540 dla Standardów i Standardowej ślepej próby.
Wyniki
Obliczenia
- Określ ΔA540 każdego Standardu vs. Standard Blank.
ΔA540 (Standard) = A540 (Standard) - A540 (Standard Blank) - Przygotuj krzywą wzorcową, wykreślając ΔA540 wzorców vs. mg maltozy przy użyciu regresji liniowej. mg maltozy przy użyciu regresji liniowej.
- Określić ΔA540 każdej Próbki vs. Próbki ślepej.
ΔA540 (Próbka) = A540 (Próbka)&A540 (próbka ślepa) - Określić mg uwolnionej maltozy przy użyciu krzywej standardowej.

gdzie:
df = współczynnik rozcieńczenia
mL enzymu = mL próbki dodanej w kroku 1b.
6.
6.
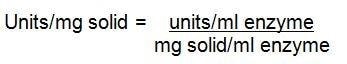
Odniesienie
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?