Metabolity - poważne wyzwanie dla separacji LC/MS i zwykłych technik detekcji
Rudi Köhling
Analytix 5, 2010
Chociaż genom wielu organizmów został zdekodowany, wiedza na temat wyrażanych białek, ich złożonych interakcji i katalizowanych reakcji chemicznych pozostaje niepełna. Metabolomika obejmuje badanie wszystkich związków i produktów reakcji biorących udział i regulujących te procesy komórkowe. Metabolomika może być stosowana do pojedynczej komórki lub całego organizmu.1
Biosynteza cholesterolu i kwasów tłuszczowych (biopaliwa)
Cholesterol jest ważną cząsteczką w organizmie człowieka. Wchodzi w skład błon komórkowych i stabilizuje dwuwarstwy lipidowe. Modyfikacje tej cząsteczki przez inne enzymy dają inną ważną grupę związków: hormony steroidowe. Hormony te odgrywają rolę w przekazywaniu sygnałów i kontrolują biosyntezę białek; na przykład estrogeny, takie jak estradiol, są odpowiedzialne za wzrost żeńskich narządów płciowych i regulują menstruację. Co zaskakujące, bloki budulcowe cholesterolu biorą również udział w biosyntezie kwasów tłuszczowych, które mogą zastąpić paliwa na bazie olejów mineralnych.2
Rysunek 1 przedstawia niektóre etapy szlaku prowadzącego do powstania cholesterolu. W dużej liczbie tych reakcji zachodzi fosforylacja ugrupowań hydroksylowych za pomocą ATP; co z kolei oznacza, że bardzo hydrofilowe związki współistnieją ze związkami hydrofobowymi, a rozdział za pomocą chromatografii stawia różne wymagania różnym fazom stacjonarnym.
Powyższy przykład zapewnia jedynie niewielki wgląd w niezliczone reakcje z tysiącami produktów reakcji i produktów pośrednich. Niektóre z tych metabolitów mają znaczenie patologiczne i odnoszą się do kilku różnych wzorców chorobowych, np. fenyloketonurii (PKU).
Oferujemy narzędzia i wiedzę do badania procesów metabolicznych i analizy metabolitów. Duża liczba certyfikowanych wzorców referencyjnych, enzymów, substratów i produktów chromatograficznych znajduje się na naszej stronie internetowej.

Rysunek 1.Biosynteza IPP i DMAP poprzez szlak mewalonianowy. Te izoprenoidowe fosforany są najmniejszymi jednostkami zaangażowanymi w produkcję wielu witamin, koenzymów, hormonów i lipidów.
Analiza metabolitów
NMR, LC/MS, CE(/MS) i GC/MS są zazwyczaj metodami z wyboru do rozdzielania, identyfikacji i oznaczania ilościowego w analizie próbek biologicznych. Jednak większość metabolitów, zwłaszcza tych wymienionych w Tabeli 1, jest bardzo polarna i nie wykazuje absorpcji UV, co wyklucza użycie detektorów UV lub fluorescencji dla HPLC. Wielkość próbki: ok. 0,3 g. Próbka może być łatwo przenoszona za pomocą strzykawki bez igły.
Corona CAD reprezentuje nową technikę wykrywania, która wypełnia lukę między detektorami optycznymi i masowymi i oferuje zarówno czułość, jak i odpowiedzi, w zależności od stężenia analitu. Wykorzystuje procesy jonizacji porównywalne do źródeł APCI i wykrywa naładowane cząstki. Cząstki powstają poprzez suszenie fazy ruchomej azotem, który jest również wykorzystywany do ładowania cząstek poprzez przepuszczenie igły wyładowania koronowego. Detektory te zyskują coraz większe znaczenie w laboratoriach analitycznych ze względu na łatwość obsługi, niską cenę i wysoką czułość w porównaniu do innych detektorów, np. współczynnika załamania światła. Mogą być stosowane do kontroli jakości, czystości i zawartości czystych metabolitów (Rysunki 2 i 3).
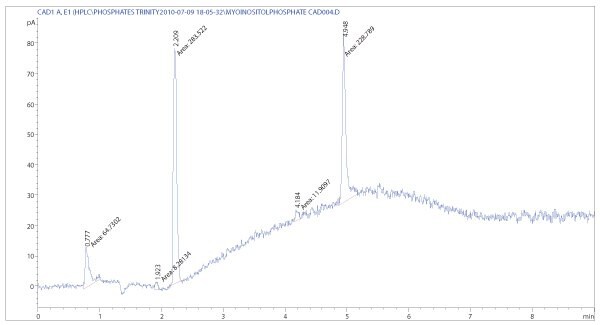
Rysunek 2.Chromatogram CAD soli sodowej trifosforanu mio-jonizitolu. Szczególną cechą tego detektora jest możliwość wykrywania również kationów alkalicznych (2,2 min). Skład fazy ruchomej można przenieść z metod LC/MS, ponieważ Corona CAD zależy również od lotnych dodatków.

Rysunek 3.Separacja fosforanów mio-inozytolu metodą HILIC. Metoda jest odpowiednia do wykrywania MS i CAD. Najlepsze kształty pików można uzyskać przy wyższym pH.
Chromatografia cieczowa
Rozdzielanie takich polarnych związków za pomocą HPLC stanowi wyzwanie dla rozwoju metody. Wymiana jonowa, HILIC lub niektóre chiralne fazy stacjonarne (np. kolumny Chirobiotic™/Cyclobond) mogą być dobrym punktem wyjścia do opracowania metody LC z wykorzystaniem detekcji MS lub CAD. Wysokie stężenia buforu i zmienne warunki pH mają istotny wpływ na retencję i kształt piku, co jest przydatne do optymalizacji. Trój- i pentafosforany mio-inozytolu można rozdzielić metodą HILIC przy użyciu kolumny Supelco® Ascentis® Express HILIC.Rysunek 3 pokazuje chromatogramy wyekstrahowanych jonów [M+H]+ .
Inny trudniejszy rozdział jest związany ze związkami fosforanowymi izoprenoidów na Rysunku 1. Fosforan izopentenylu (IP), fosforan dimetyloallilu (DMAP) i ich pokrewne pirofosforany, IPP i DMAPP, różnią się jedynie położeniem wiązania podwójnego. Jednak rozdział HPLC jest możliwy przy użyciu fazy stacjonarnej Supelco Cyclobond I 2000 (Rysunek 4).
Wreszcie, rozdział aminokwasów derywatyzowanych OPA przedstawiono na Rysunku 5. Istnieją dodatkowe metody analizy aminokwasów za pomocą HPLC opisane w literaturze.3-5 Większość z tych technik wykorzystuje derywatyzację przedkolumnową w celu zmiany polarności analitów i uczynienia ich wykrywalnymi dla detektorów UV i fluorescencyjnych. Niestety, dodatkowe piki środka derywatyzującego mogą nakładać się na piki analitu; jednak problemu tego można uniknąć, stosując kolumny ochronne i przełączając się między różnymi długościami fali.
Reakcja OPA/FMOC4 może być łatwo przeniesiona na kolumny Ascentis Express C8/C18; w szczególności standardowe systemy HPLC korzystają z ich bardzo wysokiej rozdzielczości. Tylko 5 cm kolumna jest niezbędna do rozdzielenia wszystkich 16 pochodnych aminokwasów w czasie 10 min (system Agilent® 1200).
Różne metody i techniki stosowane w metabolomice wymagają użycia wzorców odniesienia. Wprowadziliśmy nową jakość organicznych wzorców TraceCERT® zaczynając od serii aminokwasów, które są używane jako wzorce zewnętrzne do oznaczania stężeń aminokwasów w różnych matrycach. Aminokwasy są również ważnymi biomarkerami dla niektórych dziedzicznych chorób metabolicznych i mogą być wykrywane w ramach badań prenatalnych/neonatalnych.1,5 Precyzja analizy silnie zależy od dokładnej znajomości zawartości analitu we wzorcach referencyjnych. Jest to gwarantowane dzięki zastosowaniu precyzyjnych pomiarów qNMR i produkcji takich wzorców w akredytowanym laboratorium (patrz poprzedni artykuł J. Wüthricha).

Rysunek 4.Rozdzielenie IP, DMAP, IPP i DMAPP za pomocą chromatografii chiralnej z fazą cyklodekstrynową (Cyclobond I 2000).

Rysunek 5.Rozdzielenie 15 aminokwasów (pochodnych OPA) przy użyciu derywatyzacji przedkolumnowej i chromatografii w fazie odwróconej (kolumna Ascentis Express C8) zgodnie z. Wszystkie pochodne aminokwasów, jak również odczynniki, zostały bardzo dobrze rozdzielone. Pik odczynnika OPA można stłumić, stosując inną długość fali.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?