Patrick S. Stayton, Anthony Convertine, Geoffrey Berguig
Molecular Engineering & Sciences Institute, Department of Bioengineering, University of Washington, Seattle, WA USA
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.52
はじめに
ゲノミクスとプロテオミクスの進歩により、バイオ医薬品業界では新しい生物学的情報と新しい治療の標的が驚くほど蓄積されてきています。タンパク質、RNA、DNA、および細胞を用いた生物学的製剤の対象は、ゲノムの時代が持つ可能性を効果的な治療や個別化医療として実現するべく、非常に幅広くなっています。現在、生物学的製剤は臨床的に用いられている薬剤の約20~30%を占めており、安全性、特異性および個別化医療における需要に対応できるため、最も急成長している分野になっています。生物製剤のカテゴリーは、腫瘍および炎症性疾患の治療のためのモノクローナル抗体と感染症治療のためのワクチンが多数を占めています。ただし、核酸やタンパク質の治療用生物製剤の数はまだ限られており、薬物送達が困難であるために、これらの生物製剤はより大きな可能性を秘めていながらもまだ十分に活用されていません。循環、組織、および細胞レベルでの生体内の各関門を通過させることは、依然として薬効を最大化するための鍵であると同時に、広い意味では生物製剤の薬物送達の発展を引き続き妨げている要因の1つでもあります。
DNA、RNA、およびタンパク質の送達において、最も成功したものとして現在知られているのは病原体です。ウイルスやジフテリア菌などの病原菌は、核酸やタンパク質を細胞内の場所や標的に送達する非常に効果的なシステムに進化しています1。これらのウイルスや病原菌は、DNA、RNA、またはタンパク質がエンドソーム膜を通過するのを促進する注目すべき分子機械を備えています。これらタンパク質の重要な機能は、pH計測機構と密接に結びついた膜不安定化能です。生理的pH(7.4)で、これらのタンパク質は受容体介在性エンドサイトーシスにより分子内のエンドソームに取り込まれるまで「ステルス」構造をとります。エンドソームの成長に伴いpHが5.5以下に低下すると構造変化が起こり、ヘマグルチニンなどのウイルスタンパク質やジフテリア毒素などの病原性タンパク質の膜を不安定化する領域が露出します1。
私たちは、この生物学的な設計に基づき、エンドソームに典型的な特定の低pH値で膜不安定化作用を誘起するpH計測部分を組み込んだポリマーキャリアを開発しました2–7。これらのポリマーは、可逆的付加開裂連鎖移動(RAFT:Reversible Addition-Fragmentation chain Transfer)重合法8–10を用いて調製されます。最初の設計は、遺伝子(プラスミド)、アンチセンスオリゴヌクレオチド、およびRNAの送達に向けたものでした。代表的な設計では、ジメチルアミノエチルメタクリレート(DMAEMA)、2-プロピルアクリル酸(PAA)、および疎水化モノマーであるメタクリル酸ブチル(BMA)で構成される両性高分子電解質セグメントが利用されています7。pH応答性のDMAEMAとPAAは等モル比で組み込まれ、電荷が中和されて疎水化したブロックセグメントを形成します。親水性ブロックセグメントと組み合わせると、中性のpHでこのブロックはコアを形成しますが、エンドソームのpH範囲に入るとDMAEMAはプロトン化されて正電荷が増加し、PAAはプロトン化されて中性になります。これにともなうミセルの不安定化によりコアセグメントが露出するため、エンドソームのpH値でキャリアの膜は急激に不安定化するようになります。我々は、膜不安定化における固有活性とsiRNA送達活性を結びつけて、構造-活性相関を評価しました。第2ブロック中の疎水化構造であるBMAの含有量を0~50%の範囲で変化させて、7種類の一連のジブロック共重合体が合成されました。DMAEMAとPAAを等モルに保ちながらモル分率を減少させると、BMAの含有量の増加に伴い膜不安定化作用と遺伝子およびタンパク質のノックダウンが増加することが示されました(図1A、B)。この研究によって、まずキャリアの活性が確認され、その後の有効な組成を設計するにあたっての開発指針となりました4–6。
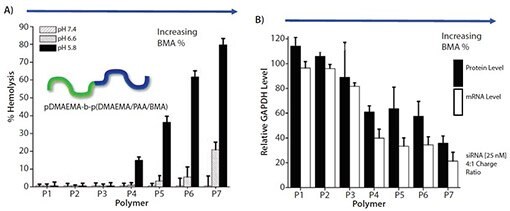
図1A)pH依存、膜不安定化溶血アッセイにおける一連のジブロックキャリア(pDMAEMA-b-(DMAEMA/PAA/BMA))の構造–活性。P1(0% BMA)、P2(1% BMA)、P3(12% BMA)、P4(19% BMA)、P5(24% BMA)、P6(27% BMA)、P7(48% BMA)。B)siRNA送達およびGAPDHノックダウンアッセイ(HeLa細胞)における一連のキャリアの構造-活性。
タンパク質およびペプチドの細胞内送達のための抗体薬物複合体
私たちは最近、抗体薬物複合体(ADC:antibody drug conjugate)を用いた方法でタンパク質およびペプチドの細胞内送達の課題に対してこれらのキャリアの設計を適応させました11,12。抗体および抗体薬物複合体治療法の導入はがん分野に大きな影響を及ぼしており、腫瘍への送達選択性を向上することで抗腫瘍活性が強化され、毒性が低減することが示されています13,14。現在のADCは低分子薬物を使用しています。これらの低分子薬物は、通常、細胞内で広く移動して細胞内の標的に到達するのに十分な疎水性を持っています。形質転換した腫瘍細胞で調節不全化または異常生成されたタンパク質をより特異的に標的にする新しい種類の生物学的製剤へと抗体標的化薬物を拡張することで、選択性のさらなる向上や新しい治療法が実現する可能性があります。新しい細胞内ポリマーキャリアの開発を進める上でのゴールは、生物学的製剤、特に細胞内の標的に対して機能するタンパク質やペプチドに適用できる、ADCのような送達システムを開発することです。これらのタンパク質薬物は、現時点では低分子薬物が適用できないような疾患に特有の標的に対してもレパートリーを大幅に拡大できる可能性があります。
RAFTポリマー合成は、エンドソームでの放出能を有する精密に制御されたヘテロテレケリックジブロック共重合体の開発を可能にします(図2)。RAFTは、合成化学の最近の進展の中で最も重要なものの1つであり、その応用により従来の高分子科学から生物学にいたる広範な分野で大きな変革が起こっています。RAFTは、簡潔で単純な技法、広い化学的適合性、そして使いやすさのために、非常に多くの用途に用いることができます。この方法は、オーストラリア連邦科学産業研究機構のRizzardoらによって最初に報告されました8。それ以降、RAFTはバイオテクノロジー向けの精巧なポリマーを調製するための最も重要な方法の1つになっています。RAFTはチオカルボニルチオ化合物を交換連鎖移動剤(CTA:chain transfer agent)として使用し、最も一般的なCTAはジチオエステルまたはトリチオカルボナートです。単にモノマー、CTA、およびラジカル開始剤の仕込み比を変えるだけで、所望の分子量をもつ低分散度の材料を調製することが可能です。この方法では毒性のある金属触媒を使用する必要がないため、特にバイオテクノロジー用途によく適しています。最も代表的な市販されているRAFTのCTAは、カルボン酸官能基を含んでおり、標準的なエステル化またはアミド化反応で修飾されます。重合プロセスの一環として官能基が導入されるため、この方法では高コストで不明確な構造を与えることも多い重合後の修飾反応が不要です。第一段階としての単独ないしは複数のモノマーの重合に続いて、得られたマクロCTAを単離して、その後のブロック(共)重合に用いることも可能です。また、RAFT重合は、適切なpH条件下であれば水中でも十分に制御できるため、様々なバイオコンジュゲーションを行うのに非常に適した手法です9。
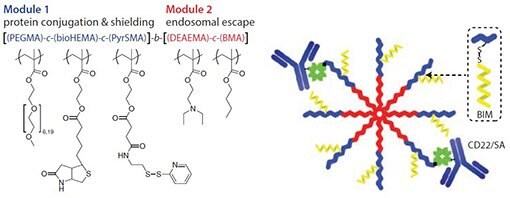
図2アポトーシス促進性BIMペプチドを充填したCD22標的化pH応答性ミセル。多機能ジブロック共重合体は2個のモジュールを用いたRAFT重合により合成されました。第1のモジュールは、立体的な遮蔽のためのPEGMA、抗CD22/ストレプトアビジン(CD22/SA)を複合化するためのbioHEMA、そしてチオール含有BIMペプチドのコンジュゲーション用のPyrSMAで構成されます。第2のモジュールは、DEAEMAとBMAで構成されるブロックで、ミセルの集合、エンドソーム脱出、BIMペプチドの細胞質への放出を促進します。
以前の研究で、RAFTによるジエチルアミノエチルメタクリラート(DEAEMA)とメタクリル酸ブチル(BMA)の共重合が、プラスミドDNAのエンドソーム脱出と細胞内送達に合わせて調節可能であることが示されています3。メタクリル酸ポリエチレングリコール(PEGMA)をモノマーとして組み込むことで、「ステルス」性を持つ立体的安定化を加え、ペプチドやタンパク質の血液循環を有利にすることが可能です15–17。コロナを形成するブロックセグメントにビオチン化したモノマーを組み込むと抗体標的化剤との結合が促進され、ピリジルジスルフィドを含むモノマーは、キャリアシステムにペプチドおよびタンパク質を可逆的にコンジュゲーションするサイトを提供します。親水性の第1ブロックは、これらの機能を持つ3種類の異なるモノマー、メタクリル酸ポリエチレングリコール、メタクリル酸ピリジルジスルフィド(PyrSMA)、およびメタクリル酸ビオチンヒドロキシエチル(bioHEMA)で構成されます。
私たちは最近発表した2報の論文で、この一般化されたキャリアシステムが、ペプチドおよびタンパク質治療薬のいずれにも合わせて設計可能であることを示しました。PEG 300とPEG 950の2つのセグメント長18で検討したところ、長鎖のPEG-メタクリレートがより良好なPKおよび腫瘍の生体内分布特性を示すことが判明しました。異種移植腫瘍モデルにおいて、抗CD22モノクローナル抗体によるヒトB細胞リンパ腫の標的化によりアポトーシス促進性BIMペプチド19が送達されました11。また、エプスタイン・バール(EB:Epstein–Barr)ヒトB細胞リンパ腫の異種移植腫瘍モデルにおいて、EBウイルス標的を攻撃するde novoタンパク質治療薬用の関連するキャリアシステムも開発されています12。このキャリアでは抗CD19モノクローナル抗体による標的化が利用されており、キャリア設計のモジュラー性が実証されました。in vitroとin vivo研究の双方で、このキャリアシステムが、活性ペプチド薬物およびタンパク質薬物を注入により投与して腫瘍細胞へと送達できることが可能であり、これら薬物の治療活性および延命効果を実現できることが示されています。
【プロトコール】ジブロック共重合体を用いた生物製剤キャリアの作製方法
PyrSMAモノマーの合成
500 mLの丸底フラスコで、モノ-2-(メタクリルオキシ)エチルコハク酸(SMA)(8.9 g、0.0387 mol、454974)をクロロホルム(300 mL)に溶解します。この溶液に、N-ヒドロキシスクシンイミド(NHS)(4.89 g、0.0425 mol、130672)を加え、N2下で30分間撹拌します。この溶液を0℃に冷却し、反応混合物をさらに30分間撹拌します。
N,N'-ジシクロヘキシルカルボジイミド(DCC)(9.57 g、0.0464 mol、379115)と触媒量の4-(ジメチルアミノ)ピリジン(66 mg、107700)を加え、溶液を0℃で1時間撹拌します。N2下の室温で22時間反応を継続させます。反応完了後、沈殿したジシクロヘキシル尿素を2回ろ過します。
2-(ピリジルジチオ)-エチルアミン塩酸塩(CAS RN® 106139-15-5、1.0 g、0.0045 mol)とEt3N(1.13 g、0.0112 mol、T0886)の溶液を0℃に冷却し、30分間撹拌します。
次に、事前に合成したNHS活性化SMA溶液(2.2 g、0.0067 mol)のクロロホルム溶液(65 mL)を1時間かけて滴下して加えます。反応混合物を室温で一夜(16時間)撹拌した後、分液漏斗に移してH2O(3 × 150 mL)で洗浄します。次に、有機相を塩水で洗浄し、Na2SO4上で乾燥し、ろ過し、真空で濃縮して油状の粗生成物を得ます。これをカラムクロマトグラフィー(SiO2、EtOAc/hexane 3:1)で精製すると、1.62 gの純生成物が得られます(収率 = 60.5%)。
参考:NMRスペクトルの帰属
アセトンD6中の500 MHz 1H NMR:δ ppm 5.81 (CH2CCH3 trans, s, 1H)、6.11 (CH2CCH3 cis, s, 1H)、1.92 (CCCH3, s, 3H)、4.35 (OCH2CH2O)、3.50 (NHCH2, t, 2H)、2.99 (NHCH2CH2, t, 2H)、2.50 (OCH2CH2COCH2, t, 2H)、2.61 (OCH2CH2COCH2, t, 2H)、8.48 (NCH, d, 1H)、7.81 (NCHCHCH, m, 2H)、7.47 (NH, b, 1H)、7.23 (CCH, d, 1H)。
bioHEMAモノマーの合成
ビオチン(2.0 g、8.19 mmol、1当量、B4501)と20 mLのDMSOを50 mLの丸底フラスコに入れます。ビオチンを暗所で一夜溶解させます。
DMAP(4.0 g、33.7 mmol、4当量、107700)とHEMA(4.2 g、33.7 mmol、4当量、128635)をこの溶液に加えます。
DMAPが完全に溶解した後、DIC(5.07 mL、33.7 mmol、4当量)を加えます。セプタムで溶液を密封し、暗所で18時間反応させます。次に、溶液をろ過した後、低温(3℃)の150 mM HEPESバッファー(pH 8.4)に沈殿させます(1~20)。ろ物を脱イオン水で徹底的に洗浄し、高真空下で乾燥します。
参考: NMRスペクトルの帰属
DMSO D6中の500 MHz 1H NMR:δ ppm 1.25~1.68 (SCHCH2CH2CH2, m, 6H)、1.88 (CH3, s, 3H)、2.31 (CH2CO2, t, 2H)、2.55 (SCH2, d, 1H)、2.82 (SCH2, dd, 1H)、3.08 (CHCH(CH2)S, m, 1H)、4.13 (CHCH(CH2)S, m, 1H)、4.29 (OCH2CH2OおよびNHC(H)CH(CH2)S ,s/m, 5H)、5.7 (CH2CCH3 trans, s, 1H)、6.03 (CH2CCH3 cis, s, 1H)、6.35および6.43 (CONHCH, s, 1H)。
マクロCTAのRAFT合成
2種類のマクロCTA共重合体は、アゾビス(4-シアノペンタン酸)(ABCVA)(11590)を開始剤、4-シアノペンタン酸ジチオベンゾアート(CTP)(722995)をRAFT剤(CTA)として使用し、20 wt%のモノマーを用いてジメチルスルホキシド中でRAFTにより合成します(スキーム1A)。
2種類のポリマーについて、初期のモノマー([M]o)対CTA([CTA]o)対開始剤([I]o)の比率は25:1:0.1です。1つの反応溶液は、仕込み濃度が80%のメタクリル酸ポリエチレングリコール(Mn 950、447951)、10%のbioHEMA、および10%のPyrSMAを含みます。もう1つの反応溶液は、仕込み濃度が85%のメタクリル酸ポリエチレングリコール(Mn 300、447935)、5%のbioHEMA、および10%のPyrSMAを含みます(スキーム1A)。
それぞれの重合溶液を20 mLのシンチレーションバイアルに入れてボルテックスし、セプタムで密封した10 mLの丸底フラスコに移し、N2下で30分間パージし、予め加熱された水浴に移して70℃で14時間加熱します。得られたポリマーをジエチルエーテルに沈殿させて単離します。
沈殿したポリマーをアセトンに溶解し、ジエチルエーテルに再沈殿します(×6)。乾燥したポリマーを1H NMRで分析し、純度を評価します。ゲル浸透クロマトグラフィー(GPC)を用いて、ポリマーの数平均(Mn)分子量と多分散度(PDI)を計算することが可能です。
GPCプロトコールの例
Tosoh SEC TSK GEL α-3000およびα-4000カラム(Tosoh Bioscience, Montgomeryville, PA)、およびOptilab TrEX屈折率検出器を備えたminiDAWN TREOS 3角度光散乱装置(Wyatt Technology, Santa Barbara, CA)を接続した1200 Series液体クロマトグラフィーシステム(Agilent, Santa Clara, CA)を使用します。60℃で0.1 wt%のLiBrを含むHPLCグレードのDMFを移動相として流量1 mL/minで使用します。逆相高速液体クロマトグラフィー(RP-HPLC)を用いて、ToおよびTxでサンプリングした反応液を測定して各マクロCTAに対するモノマーの変換率を測定することが可能です。
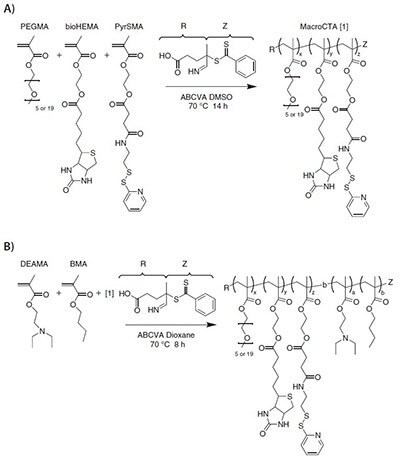
スキーム1A)ジブロック共重合体であるポリ[(PEGMA-PyrSMA-bioHEMA)-(DEAEMABMA)](O950)は、in vivoでの生体適合性のためのPEGMA950、抗体/ストレプトアビジンとの複合化のためビオチン含有モノマー(bioHEMA)、およびシステイン含有ペプチドとのジスルフィドによるコンジュゲーションのためのPDS含有モノマー(PyrSMA)を含む多機能性の親水性第1ブロックを用いて、RAFTにより合成されました。B)第2ブロックは、pHに依存して相転移を起こすDEAEMAモノマーと、膜を崩壊させる疎水性相互作用のためのBMAモノマーを含んでいます。
ジブロック共重合体のRAFT合成
前述の合成法で単離された2種類のポリマーをRAFT共重合体マクロCTAとして、ABCVA(11590)を開始剤として使用し、1,4-ジオキサン中で50 wt%のモノマーを用いて共重合を行います(スキーム1B)。[M]o:[mCTA]o:[I]oの比率は、PEGMA Mn 950(447951)を含むポリマーの場合は200:1:0.2、PEGMA Mn 300(447935)を含むポリマーの場合は125:1:0.2です。
ポリマー溶液は、相対仕込み濃度が60%のジエチルアミノエチルメタクリラート(DEAEMA、234907)と40%のメタクリル酸ブチル(BMA、235865)を含みます。
それぞれの重合溶液を20 mLのシンチレーションバイアルに入れてボルテックスし、セプタムで密封した5 mLの丸底フラスコに移し、N2下で20分間パージし、予め加熱された水浴に移して70℃で8時間加熱します。得られたポリマーを石油エーテルに沈殿させて単離します。
沈殿したポリマーをアセトンに溶解し、石油エーテルに再沈殿します(×5)。乾燥したジブロック共重合体を、上記および最近の論文に記載されているように、1H NMR、GPC、およびRP-HPLCで分析します。
抗体-ポリマー-ペプチドコンジュゲートの調製
ポリマーミセルをジスルフィド交換によりペプチドとコンジュゲーションします。
最初にポリマーをユニマーとしてエタノールに溶解し(100 mg/mL)、次にDPBS(pH 7.4)で10倍に希釈して自発的にミセルを形成させます。Amicon-4 Ultra 3k MWCOスピンカラムを使用してエタノール含有量を0.01%未満に減らし、290 nmの吸光度でポリマー濃度を確認します。
過剰量のBond Breaker TCEP溶液(Pierce)でポリマーミセル上のPDS基を還元することで、ポリマー鎖あたりのピリジルジスルフィド(PDS)基の数を定量化します。PDSの2-メルカプトピリジンへの変換により吸収が変化するので、吸光係数が8,080 M-1cm-1である343 nmの吸光度でこの変化を定量します。
次に、BIMまたはBIM/LEペプチドを無水ジメチルスルホキシド(30 mM、276855)に溶解してポリマー溶液に加え、ボルテックスしてよく混合した後、室温で一夜反応させます。最終的な反応混合物において、ポリマー濃度は500 µMで1.25モル過剰量のペプチドが存在し、ポリマー鎖あたり1個のペプチドが結合しています。グルタチオン存在下でのジスルフィド結合の還元は、HPLC精製によって確認することが可能です。
ミセルの形成およびペプチド充填の前後の数平均直径は、ポリマー濃度0.5 mg/mLで0.45 µmシリンジフィルターを用いてろ過した後、動的光散乱法で測定することが可能です。ビオチン含有ポリマーミセルのストレプトアビジンおよび抗体ストレプトアビジン複合体と複合化する能力は、HABAアッセイで定量化することが可能です。
まとめ
ここで紹介したRAFTポリマーキャリアは、精巧な機能を持つ薬物送達システムを構築するのに非常に有用です。細胞内の送達能に加えて、新たな機能性を合成的に組み込むことが可能です。例えば、循環および生体内分布の特性を最適化するためのポリエチレングリコール(PEG)の組み込みなどがあげられます。薬物のコンジュゲーションおよび標的化リガンドとなる化学物質の組込みは、機能性モノマーないしはポリマー末端に官能基を導入する機能性連鎖移動剤を用いて行うことが可能です。最後に、組成を最適化することで薬物を可溶化したり、血液中やその他の組織で酵素による分解を受けやすいような薬物を保護したりすることが可能です。
本論文の翻訳は山形大学 落合文吾教授に監修いただきました。御礼申し上げます。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
RAFT重合に関するWebinar
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?

