RAFT重合によるタンパク質およびペプチドとポリマーとのコンジュゲート
Matthias Hartlieb1, Raoul Peltier1, Sébastien Perrier1,2,3*
1Department of Chemistry, The University of Warwick, Coventry CV4 7AL, U.K., 2Warwick Medical School, The University of Warwick, Coventry CV4 7AL, U.K., 3Faculty of Pharmacy and Pharmaceutical Sciences, Monash University, VIC 3052, Australia
Material Matters, 2017, 12.
ペプチドやタンパク質のような生体高分子に合成ポリマーを結合させて修飾することで、特性が強化された極めて高度な新しい種類の生体材料が得られています。これらの材料が最初に開発された目的は、タンパク質のin vivoでの循環時間を延長するためであり、一般にPEG化(PEGylation)として知られているポリエチレングリコール(PEG:poly(ethylene glycol))を共有結合的に付与・保護することにより行われました。生体分子とポリマーのコンジュゲーションは、ポリマーの有益な機能性および高度な材料特性を可能にする、多用途性に優れた新しい重合方法が開発されたことを受けて、過去数年間にわたって急激に関心を集めています。
生体分子のポリマーコンジュゲートの合成は、収束的(convergent)な方法と発散的(divergent)な方法のどちらかを用いて行なわれます。収束的な方法では、ポリマーを個別に合成した後に生体分子とコンジュゲーションします。発散的な方法では、生体分子の存在下で重合反応を起こします(図1)1。後者の方法はさらに、グラフティングフロム(grafting-from)法とグラフティングスルー(grafting-through)法に分けられます。グラフティングフロム法では、1個以上のポリマー鎖を成長させる起点となる構造で生体分子を修飾します。グラフティングスルー法では、他のモノマーと共重合可能な構造を生体分子に接続して、生体分子で修飾されたボトルブラシポリマーを合成します。これまでに、これら材料の合成には多様な方法が用いられていますが、その中で多用途性に最も優れた強力なプロセスの1つとして注目されているのが、可逆的付加開裂連鎖移動(RAFT:reversible addition-fragmentation chain transfer)重合です。RAFT重合は、単純な装置で行える上に反応条件の自由度が高いため、無数の機能へのアクセスを実現する、生体分子の修飾に最適な方法です。

図1A)RAFT法を用いたペプチド-ポリマーコンジュゲートの合成法として想定される方法。B)RAFT重合の機構。
ペプチド-ポリマーコンジュゲートの発散的な合成法
高度に構造が制御された生体分子–ポリマーコンジュゲートの合成において、発散的な方法は収束的な方法に対して明確な利点が複数あります。例えば、低分子の開始剤を生体分子に付けた場合、ポリマー鎖のコンジュゲーションと比較して高度な制御が可能になるため、接続するポリマーの総数をより制御できます。さらに、ポリマー種を除去する必要がないため精製がより簡便です2。しかし、発散的な方法の主要な欠点として、生体分子がすべての合成段階に関与するため、重合条件に生体分子が適合しなければならないという問題があります。
RAFT重合は、堅牢で多用途性に優れるプロセスであるため、生体分子-ポリマーコンジュゲートの合成法として最適です3。ラジカル重合プロセスは、成長ラジカルがペプチドまたはタンパク質に含まれる官能基のほとんどに対して反応性を持たないため、一般にこれらの生体分子に適合します。さらに、RAFT重合では幅広い範囲のモノマーの重合が可能になります。また、触媒を使用する必要がないため、重合反応後のコンジュゲートの精製も不要です。RAFTは、熱ラジカル開始剤(I)のような外部のラジカル供給源を必要としますが、特にkpが大きなモノマー(アクリルアミドなど)の場合、通常は必要な開始剤の量が無視できるほど少ないため、連鎖移動剤(CTA:chain transfer agent)と開始剤の比(CTA/I)を高くすることが可能になります4。
発散的な方法では生体分子が重合条件に適合性を持つことが要求されるため、ポリマー合成を水溶液中で行うことが理想的です。RAFTは水系環境に適合可能であり、水溶性の連鎖移動剤を使用して多種多様な親水性モノマーを重合することが可能です5。重合プロセスの間のタンパク質またはペプチドの熱分解を抑えるために、反応温度は低く保たなければなりません。分解温度が低いラジカル開始剤(VA-044など)や、光開始剤または適切な酸化還元対などの別のラジカル供給源を使用することで、反応温度を低く保つことが可能です6。
RAFT重合の発散的な方法を用いるときに考慮すべきもう1つの基準は、CTAの安定性です。多くのRAFT剤(ジチオベンゾアートなど)は、生体分子内に非常によくみられるリジンの一級アミンなどの求核剤の存在下で不安定です。対策の1つは、求核剤に対して耐性がある、トリチオカルボナートなどのCTAを使用することです。また、重合の際に溶液のpHを変えて確実にアミン官能基の大多数をプロトン化することで、タンパク質からの干渉を受けずにRAFTを用いてポリマーを成長させることが可能になります。システインに含まれているようなタンパク質内の遊離チオールも、成長ラジカルとチオールが不可逆的に反応して鎖の成長が停止する可能性があり、RAFTに基づく重合プロセスに干渉する場合があります。合成ペプチドの場合、保護基を使用して重合後に除去することが可能です。
RAFTに基づくグラフティングフロム法
RAFT重合を用いたグラフティングフロム法を促進するためには、R基またはZ基のどちらかを介してCTAを標的のペプチドまたはタンパク質に固定する必要があります(図2)7。R基を利用する場合、生体分子が開始剤として作用し、ポリマー鎖はプロセス全体を通して生体分子に付いたままになります。この方法ではより安定なコンジュゲートが得られる一方で、成長ラジカルが停止すると、重合を再開できない失活したポリマー鎖が付いた生体分子が生成します。
CTAがZ基に付いている場合、ポリマーは溶液中で成長し、連鎖移動が起こる間だけ(CTAの付いた)生体分子に再結合します。この方法では、失活したポリマー鎖はタンパク質に再結合しないため、生体分子に付いたポリマーのリビング性が高くなります8。ただし、特に長いポリマーの場合、立体障害のため再結合段階に困難が生じ、生体分子あたりのポリマー腕の数が減少することがあります。さらに、CTAの求核剤に対する耐性が低いため、Z基コンジュゲートは比較的不安定です。一部の用途ではこの不安定さが問題になりますが、ポリマーがコンジュゲートから容易に脱離するため、ポリマーの分析(サイズ分布など)が簡単になります。
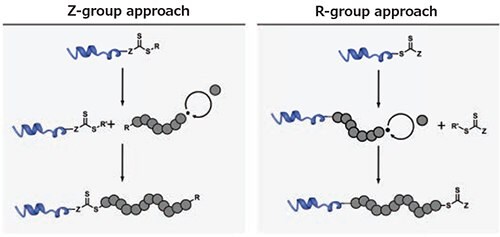
図2RAFTに基づくグラフティングフロム法を用いたR基およびZ基を使用する方法の比較。見やすくするため、付加開裂後の連鎖移動剤のR’脱離基は省略しています。
ジチオベンゾアートやトリチオカルボナートなどのCTA分子は、固相ペプチド合成に対する適合性があり、樹脂上のペプチドN-末端に付けることが可能です。開裂および重合の後、ペプチド保護基を除去して最終的なコンジュゲートが得られます9,10。他の方法として、ポリマー鎖成長のためのサイトとしてCTAをペプチド(グルタチオンまたは環状ペプチドナノチューブなど)のペンダント基に付けることも可能です11,12。RAFTに基づくタンパク質からのグラフティングフロム法は、BSA13およびリゾチーム14を使用した例が実証されており、遊離チオールないしはアミン基を活用してR基ないしはZ基とすることで行われています15。また、この方法を用いたブロックコポリマー系コンジュゲートの調製も報告されています16。
RAFTに基づくグラフティングスルー法
グラフティングスルー法では、アクリル酸系またはスチレン部分のような重合性官能基にペプチドを修飾する必要があり、通常は固相ペプチド合成の最終段階として修飾が行われます。その後、これらのマクロモノマーを重合させると、ペプチドを高密度で修飾したポリマーを得ることが可能です。この方法は、βシートを形成する配列を組み込むことで、刺激応答性のペプチドブラシを作製するために使用されています17,18。
ペプチド-ポリマーコンジュゲートの収束的な合成法
収束的な方法またはグラフティングトゥー(grafting-to)法は、特定のタンパク質サイトをポリマーのペンダント鎖または鎖末端のRAFT剤のどちらかと反応させることで行われます。この方法の利点として、RAFT重合段階において高温および有機溶媒が使用可能であり、カップリング前のタンパク質およびポリマーの特性評価が容易であることなどが挙げられます。一方、この方法では、高いカップリング効率や、タンパク質の活性を維持するために温和なグラフティング条件が必要になります。天然で利用可能なタンパク質表面の官能基は多様性に限界があるため、グラフティングトゥー段階に利用される反応は、当初、アミンおよびチオール基との反応に限られていました。しかし、バイオエンジニアリング的な手法または翻訳後修飾により非天然アミノ酸が導入されるようになり、利用可能なコンジュゲーション法が劇的に増加しています。
アミンを使用するコンジュゲーション法
多くのタンパク質表面には、大量の一級アミン(リジン残基のε-アミノ基など)が存在します。アミン基に対する最も一般的なコンジュゲーション法では、活性エステルで修飾したRAFTポリマーを使用してタンパク質との間に安定で不活性なアミド結合を形成します(図3)。N-ヒドロキシスクシンイミド(NHS)から誘導した活性エステルは、カップリングの条件が温和で効率が高いことからよく使用されています。例えば、アクリル酸のNHS誘導体はRAFTにより他のモノマーと容易に共重合するため、重合後の修飾において有効な足がかりとなります。ポリマー鎖に組み込まれるNHSを持つモノマーの比率を制御することで、タンパク質ポリマーの修飾の程度を制御することが可能です19。NHS基はコンジュゲーションの化学反応が簡単なことが特長ですが、水溶液中では加水分解する傾向があるため、代わりにメタクリル酸ペンタフルオロフェニルなどのより安定なものを用いたほうが良い場合も多くあります20。別の方法として、RAFTのCTAとして活性エステルを含むものを使用して、ポリマー鎖の末端にタンパク質1個をグラフトすることも可能です。α-カルボン酸を含むCTAは、重合の前後のいずれかに、NHSと反応させることで容易に活性エステルに変換することが可能です21。タンパク質のコンジュゲーションは、加水分解を抑えるため、弱塩基性の水中またはN,N-ジイソプロピルエチルアミンなどの有機塩基を含むDMSO中で行うことが可能です。また、アミド化を促進する水溶性のカップリング剤(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)など)を活性エステルの代わりに使用することで、RAFTポリマーのα-カルボン酸とタンパク質上の遊離アミン基を直接反応させることもできます22。さらに、酵素のような特に影響を受けやすいタンパク質は、CTAを付けた2-メルカプトチアゾリンを使用して調製されたRAFTポリマーと結合させて生分解性リンカーを作ることで、リンカーの開裂後にタンパク質活性を回復させることが可能です23。
システインを使用するコンジュゲーション法
生体高分子表面のシステイン残基の存在量はリジンと比較するとはるかに少ないため、ポリマーのコンジュゲーション後に生物活性と干渉するリスクが低減されます。最も単純な修飾法はジスルフィド結合を形成することで、通常はピリジルジスルフィドなどの活性ジスルフィド残基が使用されます(図3)。この場合も使用可能な方法は大きく分けて2つあります。ピリジルジスルフィドメタクリルアミドなどのピリジルジスルフィドを持つモノマーをRAFTにより共重合させ、チオールを有する複数のタンパク質で修飾された共重合体を得ることが可能です24。一方、ピリジルジスルフィドを持つCTAを使用すると、タンパク質の複製1個をポリマーにグラフトすることが可能になります。例えば、グルタチオンから塩基性線維芽細胞増殖因子などの大型タンパク質にいたる多様な基質とポリマーとのコンジュゲーションを行うため、3-(pyridin-2-yldisulfanyl)propyl 2-(ethylthiocarbonothioylthio)propanoateが使用されています25。生物応答性システムを調製する場合にジスルフィド結合は有用ですが、ジスルフィド結合は還元剤に影響されやすいため、一部の用途ではタンパク質-ポリマーコンジュゲートが目的より早く開裂してしまう場合もあります。
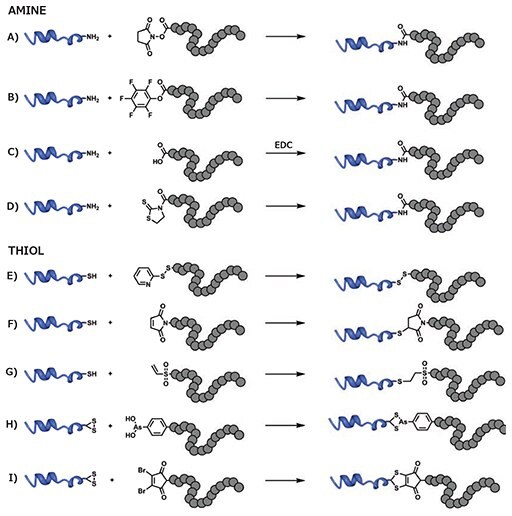
図3タンパク質のリジン残基(アミン)ないしはシステイン残基(チオール)へのRAFTポリマーのコンジュゲーション。A)アミンと<i>N</i>-スクシンイミジル活性エステルの反応を経由、B)アミンとペンタフルオロフェニル活性エステルの反応を経由、C)アミンとEDCで活性化されたカルボン酸との反応を経由、D)アミンとメルカプトチアゾリンエステルの反応を経由、E)チオールとピリジルジスルフィドの間のジスルフィド形成を経由、F)チオールのマレイミドへのマイケル付加反応を経由、G)チオールのビニルスルホンへのマイケル付加反応を経由、H)亜ヒ酸を使用したジスルフィド架橋化を経由、I)ジブロモマレイミドを使用したジスルフィド架橋化を経由。
より安定な結合を形成する方法として、α-β不飽和カルボニル(マレイミドまたはビニルスルホンなど)へのチオール基のマイケル付加反応が利用されています。1,8-ビスマレイミドジエチレングリコールをリンカーとして使用して、RAFTポリマーとウシ血清アルブミン(BSA:bovine serum albumin)またはオボアルブミンとのコンジュゲーションが行われています26。別の方法では、重合後に修飾を行うため、保護されたマレイミド部分を持つCTAが使用されています。例えば、フランで保護されたマレイミドを末端に持つ4-シアノペンタン酸ジチオベンゾアート(CPADB)が、10-dioxatricyclo[5.2.1.02,6]dec-8-ene-3,5-dioneから2段階で得られており、マレイミド末端を持つポリ(メタクリル酸メチル)(PMMA)の調製に使用されています。このように修飾されたポリマーは、続いてPBSバッファー中で単に撹拌するだけでアルブミンとコンジュゲーションします27。保護と脱保護のサイクルを避けるためには、α-β不飽和カルボニル部分を重合段階の後に付加することも可能です28。
タンパク質内のフリーのチオール残基の代わりに、ジスルフィド結合を標的にすることで、特異性を向上させることが可能です。この方法は、亜ヒ酸の三価の誘導体とRAFT重合を使用することで成功しています29。ただし、ジブロモマレイミド官能基は原子移動ラジカル重合(ATRP:atom transfer radical polymerization)の関連でしか使用されておらず、RAFTで作製したポリマーにはまだ導入されていません30
非天然アミノ酸を使用するコンジュゲーション法
サイト選択的なライゲーションを実現するために、非天然アミノ酸(UAA:unnatural amino acid)を利用する多様な生体直交型の反応が開発されています。UAAをペプチド配列に組み込むことは固相ペプチド合成法で容易に可能ですが、UAAをタンパク質へと組込むには、翻訳後修飾または細菌による発現における遺伝的にコードされたUAAの組込みのどちらかを行う必要があります31。
銅(I)媒介アジド-アルキン環化付加反応(CuAAc:copper(I)-mediated azide-alkyne cycloaddition)などの「クリック」反応は、生物学的官能基と反応性が直交する、変換率が高い、副反応が限定的、水性条件との適合性があるなどの特長を持つため、バイオコンジュゲーションに完全に適した方法です。Perrierらは、(プロパン酸プロプ-2-イニル)イルブチルトリチオカルボナートをCTAに使用して、アルキン末端を持つRAFTポリマーを調製し、アジド官能基を持つペプチドとそのポリマーを結合しました(図4)32。アジドを持つポリマーとシステインをプロパルギルマレイミドで修飾したタンパク質とのライゲーションを行うことで、この逆の合成も可能です33。ただし、この反応には、完全な変換にマイクロ波照射や毒性がある銅触媒の使用が必要であるなどの複数の欠点があり、その後の生物学的用途の妨げとなる可能性があります。より生体適合性が高い方法では、銅触媒なしでそれぞれアジドまたはテトラジンと反応できる、歪み環状アルキンまたはアルケンを使用します。マレイミド-trans-シクロオクテンはリンカーとしてリゾチーム変異タンパク質のシステイン残基を修飾するために使用されており、その後、テトラジンを持つポリマーにこのタンパク質の複製2個を結合するためにも使用されています34。また、歪みアルキンもRAFT重合の前にCTAに付けることが可能です。例えば、α-ジベンゾシクロオクチンを含むCTAを使用して重合したポリ-N-(2-ヒドロキプロピル)メタクリルアミド(PHPMA)が、アジドで修飾されたペプチドと重合後に直接コンジュゲーションされています35。

図4タンパク質の非天然系官能基へのRAFTポリマーのコンジュゲーション。A)銅(I)媒介アジド-アルキン環化付加反応を経由、B)テトラジン−trans-シクロオクテンの金属フリーライゲーション反応を経由、C)ジベンゾシクロオクチンのアジドへの金属フリーライゲーション反応を経由、D)アジドとホスフィンのStaudingerライゲーション反応を経由、E)チオール-エンのライゲーション反応を経由、F)チオエステルの末端システインへの天然の化学的ライゲーション反応を経由、G)ビオチンとアビジンまたはストレプトアビジンとの親和性に基づく非共有結合性のライゲーション反応を経由。図の球は交換可能であり、ポリマーまたはタンパク質分子のどちらかを示しています。
特異性が高い反応として、Staudingerライゲーション反応はアジドを選択的にホスフィン基に結合させるために使用されています。RAFTの用途では、2-(ジフェニルホスファニル)フェノールとの反応でホスフィンを一般的なCTAのα-カルボン酸に導入することが可能であり36、これによりアジドを含む高分子との定量的なライゲーション反応を水性環境で行うことが可能になります。より短いペプチドの場合、チオール-エンのクリック反応を用いて、アリルオキシカルボニルで保護したリジン残基に、RAFTで合成した後にアミノリシスにより末端基をチオール化したポリマーを結合することが可能です37。また、ネイティブケミカルライゲーション反応を利用して、末端に疑システインモノマー1個を導入したRAFTポリマーとペプチドチオエステルのコンジュゲーションを行うことも可能です38。
最後に、ポリマーとタンパク質のコンジュゲーションを行う洗練された方法として、真核生物の複数の生物学的プロセスに関与する補因子であるビオチンとアビジンまたはストレプトアビジンタンパク質との特異的な親和性が利用されています。ビオチンは比較的小型であるため、RAFT重合の前に容易にCTAに導入することが可能です39。
一般的なグラフティングトゥー法に関するさらに多くの情報が、Vanparijsらによる最近の包括的な論文に記載されています40。タンパク質-ポリマーコンジュゲートの合成の新しい方向として、より高度な材料を作るために、これらの反応を直交的に組み合わせて、同じポリマーに異なるタンパク質を付ける方法が利用されています。例えば、Maynardらは、二重官能性のRAFT連鎖移動剤を使用して一方の端にビオチン、もう一方の端にマレイミド基を持つポリ-NIPAMの調製に成功しています41。
結論
RAFTプロセスは多用途性に優れているため、特にペプチドやタンパク質などの生体分子の修飾に理想的な方法です。RAFTは、ペプチドやタンパク質に官能基や新たな特性を導入することを可能にするだけなく、プロセスが多用途性に優れているため、バイオコンジュゲートのために柔軟な合成法を用いることができます。現在では多種多様な合成法が確立されていることから、複雑なコンジュゲート構造により様々な分野の多数の用途への道が開かれています。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?