Humán iPSC-k robusztus differenciálása vonal-specifikus neuronokká és glia-sejtekké a kettős SMAD gátlás alkalmazásával
Nick Asbrock, Christine Chen, Vi Chu
Bemutatkozás
Az a felfedezés, hogy a szomatikus sejtek négy transzkripciós faktor (Oct-4, Klf-4, Sox-2 és c-Myc) expressziójával indukált pluripotens őssejtekké (iPS) alakíthatók, az őssejtkutatás1 izgalmas új területét hozta létre. Számos olyan emberi betegség, amelyhez korábban nem állt rendelkezésre átfogó in vitro sejtmodell, ma már modellezhető betegből származó iPS-sejtekkel. Az olyan neurológiai betegségek, mint az Alzheimer-kór, a Parkinson-kór és az autizmus az iPS-sejtes megközelítéssel modellezett első betegségek közé tartoznak. Az iPS-sejtekből származó, nagymértékben dúsított és skálázható neurális progenitor sejtek (NPC-k) vonzó alternatívát jelentenek az orvosbiológiai kutatásban a szöveti izolált primer sejtek és az immortalizált neurális őssejtvonalak helyett. Ezek az iPS-sejtekből származó NPC-k izgalmas lehetőséget kínálnak a neuronális fejlődés és a specifikus neurális sejttípusok iránti elköteleződés vizsgálatára anélkül, hogy a humán embrionális őssejtek felhasználásával kapcsolatos etikai aggályok felmerülnének.
A kettős SMAD-gátlás jól bevált módszer a neurális progenitor sejtek emberi ES- és iPS-sejtekből2 történő előállítására. Ez a protokoll két SMAD-gátlót, a Noggint és az SB431542-t használja az ES/iPS sejtek gyors differenciálódásának az NPC-k2 nagymértékben dúsított populációjává történő irányítására. A Noggin BMP-gátlóként működik, az SB431542 pedig a Lefty/Activin/TGFβ útvonalakat gátolja az ALK4, ALK5 és ALK7 receptorok foszforilációjának blokkolásával. Egy jobban meghatározott és optimalizált neuronális differenciálódási protokoll elkészítésére törekedve Li és munkatársai módosították az eredeti protokollt, hogy egy teljesen kis molekulákon alapuló differenciálódási módszert hozzanak létre, amely három kis molekulára támaszkodik a GSK-3β (CHIR99021), TGFβ (SB431542) és Notch (E vegyület) jelátviteli útvonalak gátlására, valamint a humán LIF3-ra. Ez az új, kis molekulákon alapuló neurális differenciálódási protokoll növelte a neurális differenciálódás kinetikáját, és lehetővé tette olyan valóban multipotens neurális őssejtek előállítását, amelyek reagálnak az előagy, középagy és hátsóagy neurális és gliális altípusait meghatározó regionális mintázási jelekre.
A fent leírt módszerek kombinálásával új neuronális indukciós közeget (NIM) és neuronális differenciáló közeget (NDM) fejlesztettünk ki, hogy humán ES/iPS sejtekből hatékonyan állítsunk elő neurális rozettákat, terjeszthető neurális progenitorokat, végstádiumú neurális (glutaminerg és dopaminerg) és gliális altípusokat (oligodendrociták). Ezek a közegek az általánosan használt neurális kiegészítők és kis molekulájú inhibitor-kombinációk kombinációjára támaszkodnak a multipotens NPC-k nagymértékben dúsított populációjának elérése érdekében. Számos jelentés bizonyította az NPC-k differenciálódási hajlamát egyetlen vonal felé, vagy elsődlegesen neuronális vagy gliális, de nem mindkettő felé. Az általunk újonnan kifejlesztett NIM és NDM médiumok használatával az iPS sejtekből származó NPC populációk jól reagáltak a megfelelő induktív mintázó jelekre, és mind neurális, mind gliális sejtvonal felé irányíthatók voltak.

1. ábra.Az iPS-sejtek generálásának és az azt követő neurális és gliális vonalakra történő differenciálódásának minden lépését bemutató munkafolyamat. Mindössze négy lépésben felnőtt fibroblasztok neurális és gliális vonallá alakíthatók a sejtsorsot moduláló médiakészítmények segítségével.
Módszerek
iPSC-k neuronális differenciálása neurális indukciós közeggel
iPS sejtekből származó neurális progenitor és differenciált neuronális sejteket hoztunk létre a Human ES/iPS
Cell Neurogenesis kit (SCR603). A nem differenciált iPS sejtkolóniákat 48 órán át vetettük a MEFs -re 20%-os KOSR tápfolyadékkal, amelyet 8 ng/mL FGF-2-vel (F0291) egészítettünk ki. 48 óra elteltével a növekedési táptalajt öt napon keresztül neurális indukciós táptalaj 1 (NIM1) váltotta fel, a táptalajt minden második napon cserélve. A hatodik napon a sejteket nem-enzimatikus pufferrel (S-004-C) disszociáltuk, és 0,5 mg/ml Matrigel® lemezekre ültettük a 2. neurális indukciós táptalajjal (NIM2) további öt napig, minden második nap cserélt táptalajjal. Tíz nap elteltével a neurális progenitor sejteket Accutase® reagenssel (A6964) betakarítottuk és ENStem™-A táptalajjal (SCM004) 20 ng/mL FGF-2-vel és 2 mM glutaminnal kiegészített lombikban vagy 0.1-0,2 mg/ml Matrigel® -vel 0,5-1 x 105 sejt/cm2 sűrűségben.
Neurális progenitor sejtek differenciálása neuronokká
A P3 és P8 közötti neurális progenitorokat Accutase® reagenssel (A6964 >A6964) szedtük le./a>), és az NPC-ket poli-L-ornitin/laminin, egyenként 10 μg/ml (P4957; CC095) 10-20 ezer sejt/cm2 neuronális differenciáló közeggel (SCM111), amelyet 0,5 mM dibutiril cAMP és 0,2 mM aszkorbinsav-foszfát egészítettünk ki. A táptalaj kb. 80%-át két-három naponta frissítettük, összesen 9-14 napig. A sejteket 2%-os paraformaldehiddel fixáltuk az immunfluoreszcens festés előtt. A differenciált sejtek százalékos arányát vizuális becsléssel határoztuk meg.
A neurális progenitor sejtek dopaminerg neuronokká történő differenciálása
A dopaminerg neuronok előállításához a dopaminerg differenciáló növekedési faktor mintavevő készletet (SCR128) beépítésre került a NIM-alapú neurogenezis protokollba. A NIM2 médiumba 200 ng/mL sonic hedgehogot és 100 ng/mL FGF-8-at tettünk, és a sejteket öt napig tenyésztettük. Ezután a sejteket Accutase® reagenssel egyes sejtekké szedtük, és 3 x 104 NPC-ket poli-L-ornitin- és lamininbevonatú lemezekre telepítettünk, egyenként 10 μg/mL mennyiségben, 20 ng/mL BDNF-et és GDNF-et, valamint 1 ng/mL TGFβIII-at tartalmazó neuronális differenciáló táptalajjal 14 napig. A dopaminerg neuronokat képviselő tirozin-hidroxiláz-pozitív sejteket immunfluoreszcens festéssel jellemeztük.
Neurális progenitor sejtek differenciálódása oligodendrocitákká
.Az iPS sejtekből történő oligogliális differenciálást úgy végeztük el, hogy a neuronális progenitorokat P1-ben szuszpenziós kultúrában, oligodendrocita expanziós táptalajjal (SCM107, PDGF-AA, NT3, FGF2, T3) és retinolsav tartalmú bazális médiummal 14 napig. A gliasors-alapozó neuroszférákat ezután poli-L-ornitin- és laminin-bevonatú lemezekre ültettük, egyenként 10 μg/mL mennyiségben, hogy további érlelést végezzünk Human OPC Spontán differenciáló médiummal (SCM106) 14 napon keresztül, két-háromnaponta történő médiumcserével.
A neuronális progenitor sejtek régió-specifikus mintázása
a neuronális vonalakra indukáltuk az iPS sejteket a NIM felhasználói útmutatójában leírtak szerint. Az ötödik napon a sejteket további 10 napig NIM2-ben (a spontán differenciálódáshoz), 200 ng/mL sonic hedgehogot és 100 ng/mL FGF8-at (SHH/FGF8; a sejtek középagyi sorsra való felkészítéséhez) vagy 200 ng/mL sonic hedgehogot és 1 μM retinsavat (SHH/RA; a sejtek hátsó agyi sorsra való felkészítéséhez) tartalmazó NIM2-ben tenyésztettük. 10 nap elteltével a sejteket betakarítottuk, és a génexpressziós mintázatot qRT-PCR segítségével elemeztük. A minták közötti génexpresszió normalizálására a GAPDH-t használtuk. A génexpresszióban bekövetkezett hajtásváltozásokat ΔCt értékek alapján számoltuk ki (GAPDH-ra normalizálva) és a spontán mintához (spontán, n = 2) normalizáltuk.
Eredmények
NIM1 és NIM2 médiumok használatával Oct-4-pozitív humán iPS sejtekből 10 napos differenciálódás után több mint 80%-ban Pax6-pozitív, polarizált neurális rozettákat hoztak létre. A Pax6 expressziója már 5 nap alatt növekedett, míg 10 napos tenyésztés után érett neurális rozettaszerkezetek voltak megfigyelhetők, amelyek mind a Pax6-ot, mind az N-kadherint expresszálták. A neurális rozetták disszociálhatók és 10 passzázsig kiterjeszthetők voltak Matrigel®-bevonatú tenyésztőedényeken ENStem™-A expanziós közegben, miközben a Sox-2, Nestin és N-kadherin expressziója magas szinten megmaradt.
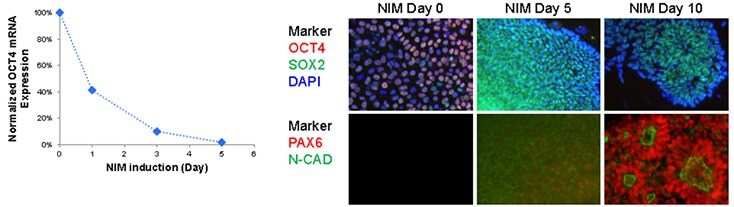
2. ábra.iPSC-k neuronális differenciálása A) A pluripotens készítő, az OCT4 gyors leszabályozása a NIM protokollban. Az Oct4 expresszióját már 24 órával a neurális indukciót követően drasztikusan lefelé szabályozták. B) A neurális makerek felfelé szabályozása a NIM protokollban. Az Oct4 expressziója 5 napos NIM után csökkent, míg a Sox2 expressziója mérsékelt növekedést mutatott a neurális indukciós idő alatt. A neurális markerek, a PAX6 és az N-kadherin 10 nap után felfelé szabályozódnak, polarizált neurális rozettaszerkezeteket képezve.

3. ábra.Az iPSC-ből származó neurális progenitor sejtek jellemzése. Az iPS sejtekből NIM segítségével nyert 3. passzázsú NPC-k tipikus neurális progenitor morfológiát mutatnak (A), és NPC markerekre, Sox-2, N-kadherin (B), Pax6 és Nestin (C) festettük őket. Ezeket a sejteket 10 passzázsra lehetett bővíteni a Nestin és a Sox-2 expressziójának fenntartása mellett.
Az iPS-sejtekből származó neurális progenitorokat tovább differenciálták terminálisan differenciált neuronokká Neuronal Differentiation Medium (NDM) segítségével. A differenciált sejtek több mint 70%-a pozitív volt TUJ1 és MAP2, az érett neuronok markerei tekintetében, míg a differenciált sejtek kevesebb mint 20%-a volt pozitív GFAP, az asztrociták markere tekintetében. A terminálisan differenciálódott neuronális sejtek az NDM használatával inkább glutaminerg (VGlut+), mint GABAerg neuronok (GAD65 -) voltak.

4. ábra.Az iPSC-ből származó NPC-k neuronális differenciálódása. A sejtek 9 napos differenciálódás után kiterjedt, kidolgozott neurit-hálózatokat mutattak. A differenciált sejtek többsége neuronális markereket, TUJ1-et és MAP2-t (A) expresszált, néhány sejt GFAP+ asztrocitává differenciálódott. (B). A terminálisan differenciálódott sejtek inkább glutaminerg (C), mint GABAerg neuronok (D) voltak.
Az ES- és iPS-sejtekből származó neurális progenitorok egyaránt irányíthatók, hogy tirozin-hidroxiláz-pozitív dopaminerg neuronokká differenciálódjanak NDM és növekedési faktorok (SCR128; SHH, FGF8, BDNF, GDNF és TGFβIII) kombinációjával. A differenciált tenyészpopuláció 10-30%-a 14 napos differenciálódás után tirozin-hidroxiláz-pozitív volt.
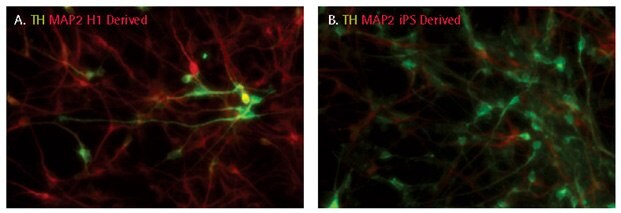
5. ábra.iPSC-ból származó NPC-k dopaminerg differenciálása. A 14 napos differenciálódás után a dopaminerg neuronokat a tirozin-hidroxiláz (TH) expressziójának követésével jellemeztük. A sejtek 10-30%-a volt pozitív a tirozin-hidroxilázra.
A humán iPS-sejtekből származó NPC-k hatékonyan tudtak differenciálódni gliális vonalba egy saját oligodendrocita differenciálódási protokoll segítségével. A differenciált populáció >80%-ban pozitív volt az A2B5, O4 és Sox10 oligodendrocita markerekre, 10%-ban GFAP pozitív és 30%-ban GalC pozitív.

6. ábra.Az iPS-sejtekből származó NPC-k oligodendrocita differenciálódása. A sejteket neurogömbök formájában oligodendrocita expanziós táptalajban és kis molekulákkal 14 napig tenyésztettük, mielőtt poli-L-ornitin- és laminin bevonatú lemezekre ültettük volna, hogy immuncitokémiai elemzéseket végezzünk A2B5 (A), O4 (B), Sox10 (C), TUJ1 és GFAP (D), NG2, GalC (E), Sox-2 és Nestin (F) esetében. A sejtek több mint 80%-a A2B5-, O4- vagy Sox10-pozitív, 10%-a GFAP-pozitív és 30%-a GalC-pozitív volt.
A humán iPS-sejtekből származó NPC-ket NDM és specifikus mintázási induktorok (SHH/FGF8 vagy SHH/retinsav) segítségével középagyi, előagyi vagy hátsóagyi neuronokká lehetett mintázni. A sikeres mintázódást qRTPCR segítségével határoztuk meg a régió-specifikus markerek expressziójának mérésére.

7. ábra.Az NPC neuronális differenciálódásának régió-specifikus mintázódása. A STEMCAA™-ból származó iPS-sejteket a leírtak szerint indukáltuk az idegi vonalakra. Az 5. napon a sejteket vagy NIM2-ben (spontán), vagy NIM2-ben 200 ng/ml sonic hedgehoggal, 100 ng/ml FGF8-mal (SHH/FGF8), vagy 200 ng/ml sonic hedgehoggal, 1μM retinsavval (SHH/RA) tenyésztettük 10 napig, hogy a sejteket a középagyi, illetve a hátsó agyi sorsra előkészítsük. 10 nap elteltével a sejteket betakarítottuk, és qRT-PCR segítségével elemeztük a génexpressziós mintázatot.
Következtetések
Egy hatékony új neurális indukciós és differenciálódási közeget fejlesztettünk ki, amellyel iPS sejtekből nagymértékben terjeszthető és multipotens neurális progenitorokat és végstádiumú neuronális és gliasejteket hozhatunk létre. Ezek a médiumok bevált kis molekulájú inhibitorokat és neurális médium-kiegészítőket használnak a gyors differenciálódási kinetika és hatékonyság elérése érdekében. Megmutatjuk, hogy az iPS-sejtekből származó NPC-k akár 10 passzázsra is kiterjeszthetők a megfelelő növekedési kinetika és marker-expresszió fenntartása mellett. Ezek az NPC-k multipotensek, és a tenyésztési körülményekbe bevitt környezeti hatásoktól függően neuronokká, asztrocitákká és oligodendrocitákká differenciálódnak. Az NPC-kből specifikus neurális altípusok, például TH+ dopaminerg és VGlut+ glutaminerg neuronok is létrehozhatók az általánosan használt növekedési faktor induktorok használatával. Ezek a közegek teljes körű megoldást nyújtanak azon kutatók számára, akik neurológiai betegségeket, például Alzheimer-kórt, Parkinson-kórt és autizmust szeretnének modellezni iPS-sejtmodellrendszerrel.
Anyagok
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?