Použití stabilizátorů a povrchově aktivních látek k prevenci agregace bílkovin

Přečtěte si více o
- Kritické faktory dlouhodobé stability proteinů
- Výrobní podmínky a zacházení s léčivými přípravky
- Stabilizátory na ochranu před mechanickým namáháním: Stabilizátory proti mechanickému namáhání: Povrchově aktivní látky a cyklodextrin
- Stabilizátory proti tepelnému namáhání: Stabilizátory: cukry, cukerné alkoholy a aminokyseliny
- Jak může čistota a kvalita surovin snížit riziko vývoje léčiv /a>
- Potřeba rozšířeného portfolia pomocných látek
Biomolekuly, jako jsou proteiny nebo mAb, jsou ze své podstaty křehké struktury stabilizované velkým počtem individuálně slabých sil. Potřebnou dlouhou dobu skladovatelnosti a různá namáhání, která se obvykle vyskytují při výrobě a manipulaci, je třeba zvládnout pomocí pomocných látek, aby vznikl stabilní, a tedy bezpečný léčivý přípravek. Uvedené pomocné látky mají nejen svou specifickou funkci, ale mohou mít také jedinečné kvalitativní vlastnosti, které pozitivně ovlivňují stabilitu bílkovin.
Kritické faktory dlouhodobé stability proteinů
Monoklonální protilátky (mAbs) a proteinové produkty získané z plazmy se používají k léčbě různých akutních a chronických onemocnění. U typického léčivého přípravku lze jeho složením umožnit skladovatelnost v délce dvou let, ale vzhledem k samotné povaze proteinů to může být náročný úkol. Termodynamické výkyvy, kterými protein během své skladovatelnosti projde, mohou vést ke vzniku populace chybně složených proteinů, což může vést k tvorbě agregačních jader a ztrátě funkce, což obojí ovlivňuje terapeutickou účinnost. Agregace může také vést k problémům s bezpečností pro pacienty kvůli potenciálu vyvolat imunitní reakci. Použitím vhodné pufrovací látky a přidáním stabilizačních pomocných látek lze snížit četnost těchto termodynamických fluktuací a zlepšit dlouhodobou stabilitu proteinu.
Kromě termodynamických fluktuací, kterým jsou proteiny vystaveny, může skladování protilátek ve skleněné lahvičce časem vést k agregaci v důsledku povrchových efektů, jako je adsorpce. Proteiny mohou vykazovat amfifilní charakter, přičemž hydrofobní zbytky aminokyselin se s větší pravděpodobností nacházejí v jádru proteinu, zatímco hydrofilní zbytky aminokyselin na povrchu usnadňují rozpustnost proteinu. Interakce proteinů s hydrofobními rozhraními včetně rozhraní kapalina - pevná látka (např. skleněná stěna lahvičky), kapalina - vzduch nebo kapalina - led vede k adsorpčním procesům. V důsledku toho může vzniknout vysoce koncentrovaný proteinový film, ve kterém mohou proteiny také podléhat částečnému rozbalování. Roztržení těchto proteinových filmů v důsledku mechanických impulzů, jako je například protřepání lahvičky, může vést ke vzniku velkých proteinových agregátů.
Výrobní podmínky a manipulace s léčivým přípravkem
Kromě problémů, které vyplývají z povahy proteinů a dlouhodobého skladování ve skleněných lahvičkách, mohou stabilitu ovlivnit i výrobní podmínky a manipulace s léčivým přípravkem.
- pH je kritickým faktorem při přípravě léčivých přípravků a je třeba vzít v úvahu jeho vliv na stabilitu proteinů.
- Přečerpávání vstupního proudu přes hadičky během purifikace nebo plnění a dokončování může způsobit mechanické namáhání léčivé látky.
- Třepání lahviček během přepravy a skladování léčiva při pokojové teplotě, např. před podáním, může ovlivnit stabilitu.
Použití vhodných pomocných látek může pomoci zaručit dlouhodobou stabilitu proteinové léčivé látky, zajistit vyrobitelnost a podpořit bezpečné zacházení.
Stabilizátory k ochraně před mechanickým namáháním: povrchově aktivní látky a cyklodextrin
K zabránění povrchové nebo mechanicky vyvolané agregaci v důsledku čerpání nebo třepání lze použít povrchově aktivní látky nebo cyklodextrin.
Jak bylo popsáno výše, povrchově indukovaná agregace proteinů je vyvolána adsorpcí proteinů na hydrofobních rozhraních, jako jsou rozhraní kapalina-vzduch a kapalina-led. Vysoce koncentrovaný bílkovinný film, který vzniká v důsledku adsorpčních procesů, může vést k tvorbě bílkovinných částic při následném mechanickém namáhání, například při míchání. Povrchově aktivní látky mohou tomuto typu agregace zabránit prostřednictvím dvou různých mechanismů (obr. 1).
Povrchově aktivní látky jsou povrchově aktivní látky a soutěží s proteiny o adsorpci na těchto rozhraních. Povrchově aktivní látky buď obsadí prostor na povrchu a zabrání adsorpci bílkovin, nebo nahradí adsorbované bílkoviny a vrátí je do kapalné fáze, čímž zabrání tvorbě bílkovinného filmu a sníží možnost agregace (Obrázek 1B).
Povrchově aktivní látky mohou také zlepšit rozpustnost bílkovin přímou interakcí s cílovou bílkovinou a působit jako chaperony (Obrázek 1C). Některé protilátky mohou vystavovat vodnému rozpouštědlu hydrofobní políčka; povrchově aktivní látky se mohou navázat na protilátku v těchto strukturních oblastech a chránit je před hydrofilním prostředím. Zakrytím těchto hydrofobních políček na povrchu proteinu povrchově aktivní látky zabraňují adsorpci protilátky na povrch nebo tvorbě agregačních jader s jinými protilátkami.
A: Adsorpce proteinů na rozhraní
B: kompetitivní povrchová adsorpce
C: vazba povrchově aktivní látky a bílkovin


Obrázek 1. Adsorpci bílkovin na rozhraní, která vyvolává tvorbu bílkovinného filmu a následnou agregaci (A), se zabraňuje přidáním povrchově aktivních látek dvěma mechanismy: kompetitivní povrchovou adsorpcí s molekulami povrchově aktivních látek pokrývajícími hydrofobní rozhraní (B) nebo přímou vazbou povrchově aktivních látek na molekuly bílkovin, čímž dojde k jejich rozpouštění v kapalné fázi (C).
Polysorbát 20 a 80 jsou běžně používané povrchově aktivní látky a jsou přítomny v 90 % schválených přípravků s monoklonálními protilátkami.1 V závislosti na použité pomocné látce a proteinu, který má být formulován, se používají koncentrace 0,01 % a 0,1 %. Poloxamer 188 je jiný typ povrchově aktivní látky, ale používá se ve stejném koncentračním režimu.
Ačkoli cyklodextriny nelze klasifikovat jako povrchově aktivní látky, bylo prokázáno, že tyto molekuly stabilizují proteiny proti napětí vyvolanému povrchem a mícháním v koncentracích již od 0,5 %.35 % (2-hydroxypropyl)-β-cyklodextrin je cyklický oligosacharid složený ze sedmi monomerů α-glukopyranózy, které tvoří dutý zkrácený kužel s hydrofilním povrchem a hydrofobní dutinou. Tyto molekuly vykazují určitou povrchovou aktivitu, která se může do jisté míry podílet na stabilizaci proteinů, i když jejich schopnost snižovat povrchové napětí je omezená.
Ve studii nucené degradace byly různé proteiny vystaveny míchání, třepání, peristaltickému čerpání a mrazu/rozmrazování. Obrázek 2 ukazuje, že vysoce čistý polysorbát 20 a polysorbát 80, poloxamer 188 a cyklodextrin zabránily agregaci proteinů v důsledku všech typů stresu, které byly použity k vyvolání agregace proteinů vyvolané povrchem nebo mícháním. Úspěšná stabilizace byla prokázána 100% obnovou monomerů a nízkým zákalem. U povrchově aktivních látek bylo tohoto cíle dosaženo při použití typických koncentrací; u cyklodextrinu se jako účinná ukázala koncentrace 0,35 %.
mAbE při smykovém napětí
mAbE při otřesech
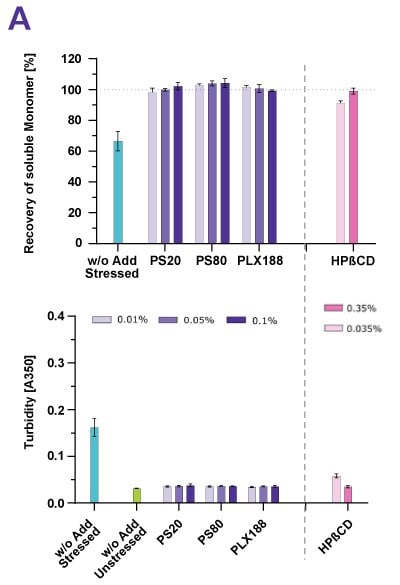

Obrázek 2. Cyklodextrin (HPβCD) účinně stabilizoval mAb bez ohledu na to, zda byl protein vystaven smykovému napětí (A) nebo třepání (B).
Stabilizátory proti tepelnému stresu: cukry, cukerné alkoholy a aminokyseliny
Pro stabilizaci proteinů proti rozbalování v důsledku faktorů, jako je tepelný stres nebo změna pH, lze použít cukry, cukerné alkoholy a aminokyseliny. Tyto molekuly posouvají rovnováhu mezi nativními a částečně rozloženými proteiny způsobem, který zvyšuje stabilitu.
Existují dva mechanismy, kterými může příslušná chemická látka fungovat (obrázek 3A):
- Pomocná látka, která je přednostně vyloučena z povrchu proteinu, posiluje hydratační obal kolem protilátky a posouvá rovnováhu směrem k nativně složenému stavu (obrázek 3B).
- Pokud chemická látka přednostně váže částečně nesložený protein, zabraňuje agregaci a další degradaci (obrázek 3B). Tím pomocné látky umožňují následné opětovné skládání do nativního stavu v průběhu času nebo po odstranění stresové podmínky.
A: Bez pomocné látky
B: Přednostní vyloučení
C: Přednostní vazba
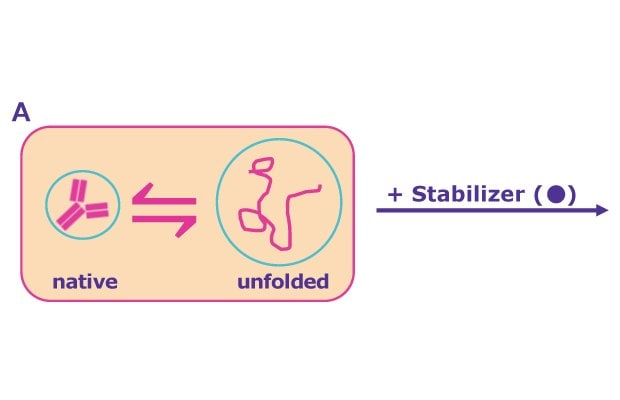

Obrázek 3. V roztoku existuje dynamická rovnováha mezi přirozeně složeným a (částečně) rozloženým stavem proteinu - ten je náchylný k agregaci (A). Stabilizátory mohou posunout rovnováhu směrem k nativně složenému stavu prostřednictvím přednostního vyloučení pomocné látky z povrchu proteinu a hydratace molekuly proteinu (B). Jiné stabilizátory působí prostřednictvím přednostní vazby na částečně rozložený stav proteinu, zabraňují agregaci a další degradaci a pozdějšímu opětovnému skládání (C).
Pro stabilizaci proteinů lze použít několik aminokyselin. Páteř glycinu, která je společná všem aminokyselinám, má dobře známé stabilizační vlastnosti. Arginin obsahuje guanidinovou skupinu, která má delokalizovaný kladný náboj, a jako taková může interakcí s aromatickými zbytky pomoci rozpustit cílový protein nebo snížit viskozitu přípravku. Histidin je další stabilizující aminokyselinou a běžně se používá jako pufr pro formulace monoklonálních protilátek.
Cukry a cukerné alkoholy se používají jako stabilizátory proteinů proti tepelným a termodynamickým účinkům, včetně sacharózy, trehalózy a myo-inositolu. Za účelem prokázání stabilizačního vlivu cukrů byly různé protilátkové léčivé přípravky, včetně fúzního proteinu a dvou ADC-mimik, vystaveny podmínkám nucené degradace. Pro zajištění srovnatelnosti výsledků byla zvolena teplota o 10 °C nižší, než je střední bod tepelného přechodu jednotlivých proteinů. Vzorky byly zkoumány na zákal, obsah monomerů, čistotu monomerů a agregáty a také vizuální kontrolou. Obrázky 4A-D ukazují příklad souboru dat pro protilátku Denosumab.
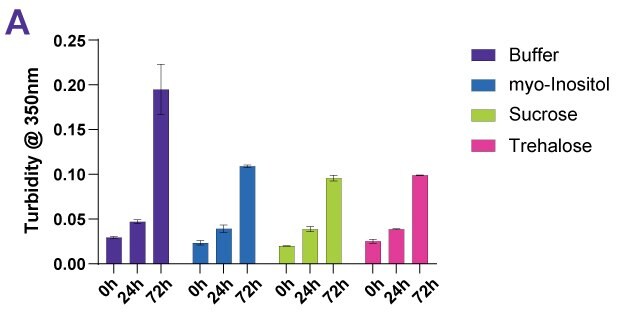
Obrázek 4A.Vliv různých proteinových stabilizátorů po nucené tepelné degradaci denosumabu měřený pomocí zákalu.

Obrázek 4B.Vliv různých proteinových stabilizátorů po nucené tepelné degradaci denosumabu měřený podle obsahu monomerů.
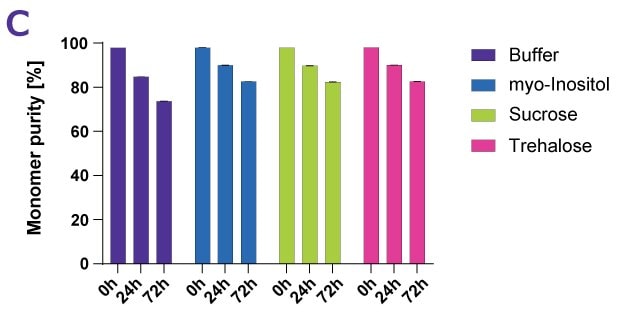
Obrázek 4C.Vliv různých proteinových stabilizátorů po nucené tepelné degradaci denosumabu měřený podle čistoty monomerů.

Obrázek 4D.Vliv různých proteinových stabilizátorů po nucené tepelné degradaci denosumabu měřený podle procenta agregátů.
Tabulka 1 ukazuje srovnatelný stabilizační účinek cukerného alkoholu myo-inositolu a sacharózy a trehalózy na bílkoviny.
Sacharóza a trehalóza se kromě klasických kapalných přípravků používají také jako stabilizátory při lyofilizaci. Spolu s objemovými činidly, jako je sorbitol nebo mannitol, tvoří cukry skelnou matrici, která stabilizuje proteiny nahrazením vody a vitrifikací. Během procesu sušení mohou stabilizátory nahradit vodu ve vodíkové vazbě s proteinem; díky tomu může být zachována nativní struktura i při nepřítomnosti vody. Vitrifikace stabilizuje molekuly vytvořením tuhé skleněné matrice. V této matrici již není termodynamická rovnovážná dynamika relevantní a proteiny jsou stabilizovány kineticky. Zatímco cukry, jako je sacharóza a trehalóza, poskytují přiměřeně vysokou teplotu skelného přechodu, lze k posílení vodíkové vazby k imobilizovanému proteinu použít jiné pomocné látky.
Příkladem běžně používaných objemových látek jsou sorbitol a mannitol. Kromě toho, že působí jako stabilizátory bílkovin, mohou tato objemová činidla zkrátit dobu sušení, čímž se zefektivní proces lyofilizace. V závislosti na způsobu lyofilizace přípravku mohou také působit jako látky zvyšující rekonstituci. Je však třeba poznamenat, že objemová činidla jsou obvykle změkčovadla, která snižují teplotu skelného přechodu formulace. Aby byla lyofilizovaná formulace stabilní, musí být skladována při teplotě přibližně o 30 °C nižší, než je teplota skelného přechodu. Během vývoje formulace musí být optimalizován proces lyofilizace a také výběr a množství pomocných látek, které se používají, aby vznikla stabilní formulace.
Čistota a kvalita surovin může snížit riziko vývoje léku
Konečný léčivý přípravek musí splňovat vysoké bezpečnostní standardy a být v souladu s mnoha předpisy. Existují například přísné limity na množství bioburden a endotoxinů v léčivém přípravku. Vysoce kvalitní suroviny vyráběné za kontrolovaných podmínek mohou dále minimalizovat riziko nesplnění bezpečnostních požadavků. Kromě hladiny bioburden a endotoxinů jsou neméně důležité i další atributy kvality specifické pro pomocné látky.
Polysorbáty jsou například náchylné k oxidaci a hydrolýze; výsledné produkty degradace zahrnují mastné kyseliny a peroxidy, které negativně ovlivňují stabilitu bílkovin. V průmyslu existuje trend vyvíjet stabilnější povrchově aktivní látky a nakonec polysorbáty nahradit. Zatímco tato nová řešení jsou stále ve vývoji, doporučuje se používat polysorbáty v nejvyšší třídě čistoty, pokud nelze uvažovat o poloxameru 188 nebo cyklodextrinu.
Další kvalitativní vlastnosti sacharózy jsou rovněž rozhodující. Některé šarže sacharózy mohou obsahovat nanočástice nečistot, které mohou být zaměněny za bílkovinné agregáty a způsobit falešné analytické výsledky. Navíc tyto nanočásticové nečistoty mohou tvořit jádra pro agregaci bílkovin. Výroba sukózy v kontrolovaném prostředí může snížit množství nanočásticových nečistot a minimalizovat riziko skutečné nebo analyticky falešné agregace bílkovin.
Při použití ve formě prášku má glycin velkou tendenci ke spékání; vzniklé glycinové koláče lze obtížně rozdělit, což značně znesnadňuje jejich použití při výrobě. Granulovaný glycin má značně sníženou tendenci k tvorbě koláčů a nabízí lepší tekutost a rychlé rozpouštěcí chování, což jej činí vhodnějším pro použití v bioprocesech.
Potřeba rozšířeného portfolia pomocných látek
Při výrobě a konečném použití je léčivý přípravek vystaven mnoha faktorům, které mohou způsobit nestabilitu a agregaci. Pomocí různých pomocných látek lze vytvořit přípravek, který zajistí dlouhodobou stabilitu a poskytne odolnost vůči těmto stresovým faktorům.
Kromě různých mechanismů, které mohou vést k agregaci proteinů, mohou být protilátkové léčivé přípravky velmi různorodé, liší se hydrofobicitou, rozložením náboje a glykosylací. Ačkoli polysorbát 20 a 80, poloxamer 188 a cyklodextrin mohou chránit proteiny před mechanickým namáháním, je obtížné spolehlivě a s jistotou předpovědět, která pomocná látka je pro konkrétní protein nejlepší volbou. Totéž lze říci o pomocných látkách stabilizujících proti tepelným a termodynamickým faktorům. Proto je nezbytné mít přístup k širokému portfoliu vysoce kvalitních pomocných látek, které řeší celou řadu formulačních problémů.
Podrobnější informace o mechanismech podílejících se na tvorbě proteinových částic a o tom, proč jsou k zabránění agregace proteinů zapotřebí různé třídy pomocných látek, najdete v našem webináři na vyžádání "Jak zabránit agregaci proteinů pomocí stabilizátorů a povrchově aktivních látek".
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?