ROAPRO
Roche
Aprotinin
from bovine lung
Synonym(e):
Aprotinin, Pankreatischer Trypsin-Inhibitor, Trypsin-Inhibitor, pankreatisch (bpti), Trypsin-Kallikrein-Inhibitor
About This Item
Empfohlene Produkte
Biologische Quelle
bovine lung
Qualitätsniveau
Form
lyophilized
Verpackung
pkg of 10 mg (10236624001)
pkg of 100 mg (11583794001)
pkg of 50 mg (10981532001)
Hersteller/Markenname
Roche
Methode(n)
electrophoresis: suitable
tissue culture: suitable
pH-Bereich
3-10
Löslichkeit
water: soluble 10 mg/mL
Absorption
0.84 at 280 nm
Versandbedingung
wet ice
Lagertemp.
2-8°C
Allgemeine Beschreibung
Spezifität
Cathepsin G, Akrosin, menschliche Leukozytenelastase und menschliche Uokinase werden schwach gehemmt. Faktor Xa, Thrombin, Subtilisin, Papain, Pepsin, Angiotensin-konvertierendes Enzym (ACE), Carboxypeptidase A und B, andere Metallproteasen und Thiolproteasen werden nicht gehemmt.
Anwendung
- Weitere Anwendungen: Aufreinigung von Urokinase, Trypsin und Chymotrypsin auf immobilisiertem Aprotinin
- Quantifizierung der Kallikreinaktivität in Mischungen aus Esterasen und Proteasen
- Kontrollierter Abbau von Substraten durch das Vermeiden von nichtspezifischer Proteolyse in klinisch-chemischen Tests
- Aprotinin ist ein Modellprotein für Proteinfaltungsstudien
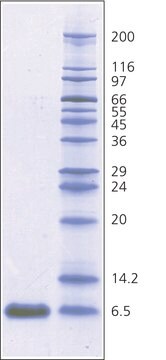
- Molekülmassenmarker in SDS-Polyacrylamid-Gelelektrophorese
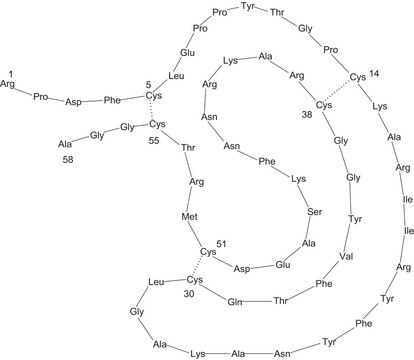
Sequenz
Einheitendefinition
Eine Inhibitoreinheit (IU) (+25 °C, BAEE als Substrat) entspricht etwa 2,8 Inhibitoreinheiten (+25 °C, Chromozym TRY als Substrat).
Eine Inhibitoreinheit (IU) (+25 °C, BAEE als Substrat) entspricht etwa 26 Kallikrein-Inhibitoreinheiten (KIU) (+25 °C).
Eine Inhibitoreinheit (IU) (+25 °C, BAEE als Substrat) entspricht etwa 0,067 Inhibitoreinheiten (+25 °C, Bz-D,L-Arg-4-Na als Substrat, Trypsinbestimmung bei pH-Wert 7,8).
Eine Kallikrein-Inhibtoreinheit = 0,17 μg kristallines Aprotinin.
Angaben zur Herstellung
Arbeitslösung: Wasserlösliche (10 mg/ml) oder wässrige Pufferlösung (z. B. 0,1 M Tris, pH-Wert 8,0).
Hinweis: Um die Adsorption von Aprotinin auf negativ geladene Festphasen, z. B. Chromatographiegele, Ultrafiltrationsmembranen, zu vermeiden, sollte die NaCl-Konzentration oberhalb von 0,1 M liegen, oder es sollten während der Trennung andere geeignete Salze zu allen Puffern hinzugefügt werden.
Lagerbedingungen (Arbeitslösung): -15 bis -25 °C
Rekonstituierung
Aliquoten, die bei -15 bis -25 °C gelagert werden, sind etwa 6 Monate lang stabil.
Hinweis: Wiederholtes Einfrieren und Auftauen sowie das Aussetzen gegenüber stark alkalischen Lösungen ist zu vermeiden (inaktiv bei pH-Wert > 12,8).
Sonstige Hinweise
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
fractional diagonal chromatography
Kinase and Phosphatidylinositide 3-Kinase/Akt Signaling
Artikel
While aprotinin and bovine pancreatic trypsin inhibitor (BPTI) are the same protein sequence, the term aprotinin is typically used when describing the protein derived from bovine lung.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.