Allgemeine Beschreibung
Kollagen Typ I [1α(l)]2α2 findet sich im Körper verteilt. Dieses fibrilläre Kollagen kommt in Haut, Knochen, Sehnen, Bändern, Dentin, Faszien, Lederhaut, Cornea, Organkapseln und Faserknorpeln vor. In Gewebe liegt es als die klassisch benannten Kollagenfasern, die aus dicht gepackten, dünn gestreiften Fibrillen mit variierendem Durchmesser gebildet werden, vor. Kollagen I wird hauptsächlich von Fibroblasten, Osteoblasten, Odontoblasten und Chondroblasten synthetisiert. Kollagen Typ Iα1 (COL1A1) wird von dem Gen, das sich auf dem menschlichen Chromosom 17q21.33 befindet, codiert. Es ist das am häufigsten vorkommende extrazelluläre Matrix(EZM)-Protein beim Menschen. Kollagen Typ I ist das wichtigste Strukturprotein von Knochen, Sehnen, Haut und Cornea. Das kodierte Protein ist ein Heterotrimer, das aus zwei α1-Ketten und einer α2-Kette besteht.
Kollagen Typ I trägt maximal zum Faserproteingehalt von Säugetieren bei. Es kommt außerdem in Arterien und der extrazellulären Matrix vor. Das Protein weist eine längliche Zylinderstruktur mit sich verjüngenden Enden auf. Es hat eine linksgängige Helix mit drei Polyprolin-II-artigen Polypeptidsträngen.
Spezifität
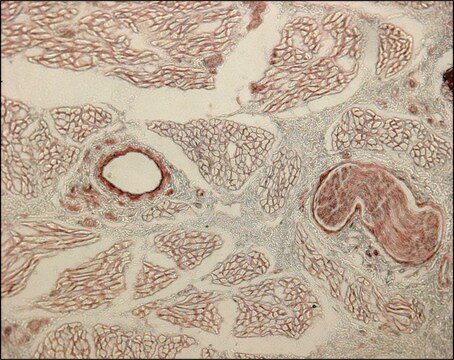
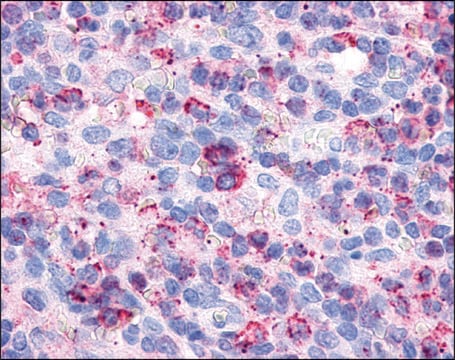
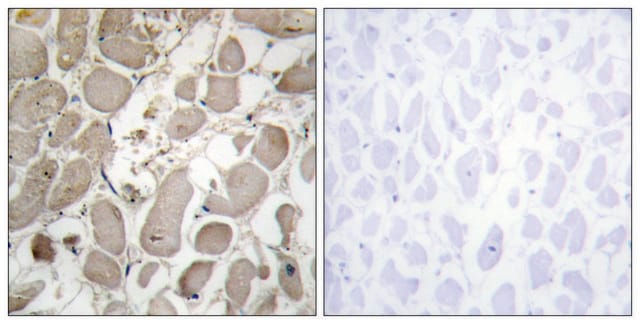
Der Antikörper ist reaktiv gegenüber der nativen (spiralförmigen) Form von Kollagen Typ I in ELISA und Dot Blot. Dieses Produkt ist nicht reaktiv, wenn es an thermisch denaturierten Molekülen getestet wird. Bei der immunhistochemischen Färbung von acetonfixierten und nicht fixierten gefrorenen Schnitten ist eine starke Färbung der Bindegewebefasern erkennbar. Mit Dot-Blot- und ELISA-Verfahren zeigt der Antikörper keine Kreuzreaktion mit Kollagen der Typen II, III, IV, V, VI, VII, IX, X und XI. Das von dem Antikörper erkannte Epitop ist empfindlich gegenüber routinemäßiger Formalinfixierung und Paraffineinbettung.
Immunogen
Kollagen Typ I der Rinderhaut
Anwendung
Der monoklonale Anti-Kollagen-Typ-I-Antikörper der Maus wird eingesetzt für:
- Immunhistochemie
- Dot-Blot-Verfahren
- Indirekte Immunfluoreszenzfärbung
Monoklonaler Anti-Kollagen-Antikörper Typ I kann für die Lokalisierung von Typ I Kollagen mit verschiedenen immunchemischen Assays, einschließlich ELISA, Dot Blot und Immunhistochemie, verwendet werden. Eine minimale Arbeitsverdünnung von 1:2.000 wurde durch indirekte immunfluoreszierende Färbung von gefrorenen Schnitten von Menschen oder anderen Säugetieren bestimmt.
Biochem./physiol. Wirkung
Kollagen Typ I ist verantwortlich für die mechanische Stabilität, Elastizität, Festigkeit und Zähigkeit von Sehnen, Bändern, Haut, Cornea, Knochen, Dentin und vielen anderen Geweben.
Kollagen Typ I nimmt eine strukturbildende Rolle in der extrazellulären Matrix ein, indem es eine mechanische Stütze sowie eine Resistenz gegenüber Spannung verleiht. Einige der wichtigeren genetischen Erkrankungen, an denen dieser Kollagentyp direkt oder indirekt beteiligt ist, umfassen die meisten Fälle von Osteogenesis imperfecta sowie bestimmte Arten von Ehlers-Danlos-Syndrom. Die Entwicklung von Antikörpern gegen Kollagene erwies sich als wirksame Methode zur Untersuchung der Verteilung dieser Bindegewebsproteine und zur Untersuchung der epithel-mesenchymalen Wechselwirkungen, Tumorgenese und Basalmembranbiologie bei der Onthogenese und Epitheldifferenzieung.
Physikalische Form
Flüssig
Lagerung und Haltbarkeit
Bei 2 bis 8 °C bis zu einem Monat haltbar. Zur Langzeitlagerung in Arbeitsaliquoten einfrieren. Wiederholtes Einfrieren und Auftauen wird nicht empfohlen. Eine Aufbewahrung in „frostfreien“ Gefrierschränken wird nicht empfohlen. Falls nach längerer Lagerung eine leichte Trübung eintritt, die Lösung vor der Verwendung durch Zentrifugieren klären.
Haftungsausschluss
Sofern in unserem Katalog oder anderen Begleitdokumenten unserer Produkte nicht anders angegeben, sind unsere Produkte nur für Forschungszwecke vorgesehen und nicht für andere Zwecke zu verwenden, einschließlich, jedoch nicht beschränkt auf unautorisierte kommerzielle Verwendung, zur In-vitro-Diagnostik, für Ex-vivo- oder In-vivo-Therapiezwecke oder jegliche Art der Einnahme oder Anwendung bei Menschen oder Tieren.