O- 連結糖蛋白通常是分子質量為 >200 kDa 的大型蛋白質。 糖基化通常發生在高密度的簇中,可能佔整體質量的 50-80% 之多。
結構
O-連結聚糖最常透過絲氨酸(Ser)或蘇氨酸(Thr)殘位連結到肽鏈上。雖然 O-連結主要是透過羥基與肽殘基連結,但並不需要共識序列。酪氨酸(Tyr)、羥基甘氨酸(Hydroxy-Lys)或羥基脯氨酸(Hydroxy-Pro)也可能是 O-連鎖糖基化的肽位點。
最常見的 O-連鎖聚糖是黏蛋白型聚糖,其中包含一個初始 GalNAc 殘基。有八種黏蛋白型核心結構(圖 1)。即使是常見的黏蛋白型核心,O-連結的聚糖也往往非常異質,除了幾種鋸齒狀的核心結構之外,還有其他可能的結構。不過,O-連結的聚糖通常是線性或雙鏈的,分支相對地比 N-聚糖少。

圖 1.黏蛋白型 O 型糖的核心結構。
黏蛋白是含有大量高密度的O-連鎖聚糖簇的糖蛋白。 這些蛋白的黏蛋白型聚糖在水溶液中經常形成交聯連接,形成高黏度的凝膠(黏液)。 Mucins 可以分泌,但也可能與膜結合,並在細胞表面形成聚糖密集區域。
除了黏蛋白型聚糖之外,O-連鎖聚糖也可能納入 GalNAc 以外的糖,作為與丝氨酸/蘇氨酸殘基結合的初始糖。 替代性 O-鏈結聚糖的例子有:
- 含有 GlcNAc 作為初始糖的核和胞質糖蛋白。
- 以岩藻糖為起始糖的纖維蛋白溶解因子和凝血因子。
- 以甘露糖為起始糖的甘露蛋白是酵母菌的典型蛋白。O-Mannosyl glycans 也存在於人類 α-dystroglycan 和其他神經系統糖蛋白中。
- 蛋白多糖結構的組成物--糖胺聚糖 (GAGs),含有只與絲氨酸殘基結合的木糖。
- 植物細胞壁擴展蛋白,含有與羥脯氨酸結合的阿拉伯糖和與絲氨酸結合的半乳糖。
- 植物阿拉伯半乳聚醣(rabinogalactans)透過 O-鏈接的半乳糖或葡萄糖附著於肽骨架內的羥脯氨酸。
- 膠原蛋白三重螺旋結構內與羥基甘氨酸結合的半乳糖和 αGlc(1→2)Gal 殘基。補體因子 C1q 也含有 αGlc(1→2)Gal- 羥脯氨酸序列。
- 糖原蛋白是糖原合成所需的蛋白質前體,含有與酪氨酸 O 型連結的葡萄糖;最初的葡萄糖隨後會被糖原合成酶拉長以產生糖原。
生物合成和降解
O-連鎖糖基化是在高爾基(golgi)中發生的真正的翻譯後事件,蛋白質轉移不需要寡糖前體。丝氨酸/苏氨酸残基通过共价添加N-乙酰半乳糖胺残基直接修饰。黏蛋白型 O-糖基化的啟動取決於多肽 N-乙酰半乳糖基轉移酶 (ppGalNAcT);目前已發現至少有十二種哺乳類動物的 ppGalNAcT 同工酶。黏蛋白型聚糖合成的第一步需要 ppGalNAcT 在 UDP-GalNAc 作為碳水化合物供體的情況下進行催化。隨後 O 連結聚糖的延伸和終止由幾種糖基轉移酶完成。不同糖基转移酶的相对表达和亚细胞分布决定了 O-聚糖生物合成的结果。 O-连接聚糖的终止通常包括 Gal、GlcNAc、GalNAc、Fuc 或硅酸。到目前為止,核心 Gal-β(1→3)- GalNAc 最常見的修飾方式是單-、二-或三-ialylation(核心 1 和 2)(圖 2)。較不常見但廣泛分佈的 O-連鎖六糖結構包含 β(1→4)- 連鎖的 Gal 和 β(1→6)- 連鎖的 GlcNAc,以及矽ialic acid.
。
圖 2.二ialylated (上) 和三ialylated (下) O-連鎖核心 1 聚糖。
O-聚糖降解除了需要 N-聚糖降解所需的外糖苷酶外,還需要 α-N- 乙酰半乳糖苷酶。
功能
上皮細胞頂端膜上泌出的黏蛋白可透過二硫鍵連結並捕捉水分子,形成黏液膜。這層黏液膜能保護細胞免受敵意環境因素(如胃酸和循環蛋白質酶)的侵襲。唾液腺分泌的黏液素可為吞嚥提供潤滑作用。黏蛋白也能阻擋病原體的感染,因為黏蛋白會呈現一層 O 連結醣壁,吸引並結合細菌的碳水化合物結合受體。許多細菌病原體會表達黏著素,黏著素是專門針對細胞表面 O 型糖結構的碳水化合物辨識蛋白,可作為結合和感染宿主細胞的受體。這些黏著蛋白會與黏蛋白表面的醣結合,阻止病原體進一步發展;結合的病原體就可以被消除。
單一 GlcNAc 分子的糖基化是一種獨特的 O-糖基化形式,因為它已被證實是動態的,而不是像其他類型的 O-連結糖基化一樣是靜態的。這種修飾是可逆的,由尿苷二磷酸-N-乙酰葡萄糖氨基轉移酶(polypeptide β-N-acetylglucosaminyltransferase,O-GlcNAc 轉移酶)和中性β-N-乙酰葡萄糖氨基酶(neutral β-N-acetylglucosaminidase,O-GlcNAcase)催化。與 GlcNAc O-連鎖的蛋白質可能會在相同的肽位點被磷酸化,與磷酸化類似,O-GlcNAc 處理與細胞信號傳導事件有關,包括胰島素信號傳導和 RNA 轉錄調節。1,2
更複雜的 O-聚糖具有其他功能。ZP 糖蛋白是高濃度存在於哺乳類動物卵子周圍透明帶中的 O 連結糖。人的 ZP 矩陣含有四個 ZP 糖蛋白,而小鼠的 ZP 矩陣只有三個。3 ZP 糖蛋白的作用尚未完全確定,但被認為與精子接收有關。
O 連結聚糖也參與造血和炎症反應機制。P-selectin glycoprotein ligand 1(PSGL-1)除其他聚糖外,還含有一個以 sialyl Lewis X(C2-O-sLeX,圖 3)封頂的核心 2 O-聚糖。PSGL-1 是 P-selectin 的主要黏附目標,也是 E-selectin 的目標,P-selectin 參與白血球滾動和招募到發炎部位。

圖 3.附有 sialyl Lewis X (sLex) 分子的 O 連結核心 2 聚糖的結構。
人類 ABO 血型抗原是小的 O 連結醣,可能附著在膜糖蛋白或細胞表面糖脂上。這些抗原也可能作為游離寡糖或可溶性糖蛋白和糖磷脂的成分由組織分泌。血型 O(H) 決定性並不會產生免疫反應,但當加入 α(1→3)GalNAc (血型 A 抗原) 或 α(1→3)Gal (血型 B 抗原) 改性後,所產生的三糖會啟動免疫反應 (Figure 4)。
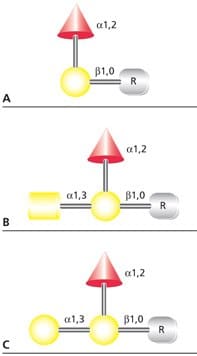
圖 4.(A) 血型 H(O)、(B) 血型 A 及 (C) 血型 B 抗原的結構。R 代表抗原的含羥基胺基酸或脂質結合部位。
T抗原和Tn抗原是具有不完全糖基化的O-聚糖。T抗原(腫瘤相關抗原或TF(Thomsen-Fridenreich)抗原)是核心1二糖(Gal-β(1→3)GalNAc),經病毒或細菌的神經醯胺酶脫氨作用後產生。T 抗原也可能因可用的糖基转移酶改變而產生。Tn 抗原是未經糖基轉移酶延伸成完整核心結構的 O 連結 GalNAc。這些抗原不會在正常細胞表面表達,但常見於癌細胞,可作為腫瘤標誌物。
辛德勒氏病已被確認為一種先天性糖基化失調,會影響 O 連結聚糖,是由α-乙醯半乳糖苷酶缺乏所致。
Network error: Failed to fetch
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。