組織樣本中的蛋白酶 K
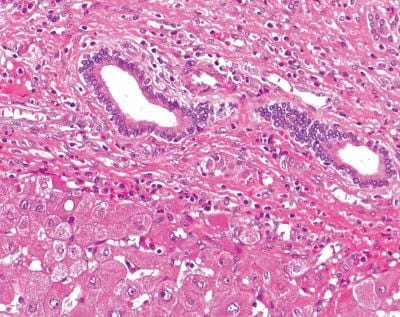
福爾馬林固定、石蠟包埋 (FFPE) 的肝臟組織經紅蘇木精和伊紅 (H&E) 染色
蛋白酶 K 是一種廣譜絲氨酸蛋白酶,常用於從組織樣本中分離核酸。它的作用是消化組織樣本中的蛋白質,這些蛋白質會干擾核酸的分離和純化。
組織樣本通常含有各種蛋白質,包括組織蛋白、核酸酶和其他酵素,這些蛋白質會降解 DNA 和 RNA,並干擾 PCR 和測序等下游應用。
蛋白酶 K 可以分解這些蛋白質,將核酸從組織基質中釋放出來,並減少它們被內源酵素降解的情況。
蛋白酶 K 可以在各種條件下有效地消化蛋白質,包括高溫、高鹽濃度和有去垢劑的情況下。
使用蛋白酶 K 消化後,核酸可以使用各種方法進一步純化,例如酚-氯仿萃取、柱式純化或磁珠式純化。純化後的核酸可用於下游應用,例如 PCR、測序或雜交分析。
如何用蛋白酶 K 從組織樣本中分離核酸?
從組織樣本中分離核酸通常涉及幾個步驟,包括組織均質化、用蛋白酶 K 消解蛋白質以及純化核酸。以下是程序的一般概述:
1. 組織均質化:首先將組織樣本均質化,以破壞組織基質並釋放核酸。
2.蛋白消化:蛋白酶 K 被添加到均質化的組織樣本中,以消化蛋白質並釋放核酸。所需的蛋白酶 K 量會因組織類型和使用的組織量而異。一般而言,每毫升組織勻質液會使用 100-200 μg 的蛋白酶 K。消化可在 37-65 °C 下進行,時間從 30 分鐘到數小時不等,視組織類型和所需蛋白質消化程度而定。
3.蛋白酶 K 的失活:蛋白質消化後,蛋白酶 K 通常會在 95-100 °C 下加熱樣品 10-15 分鐘,使其失活。這有助於確保蛋白酶 K 完全失活,不會干擾下游應用。
4.核酸純化:然後從蛋白酶 K 處理過的樣品中純化核酸。這可以用多種方法完成,包括酚-氯仿提取、柱式純化或磁珠式純化。純化方法的選擇取決於所需核酸的類型和數量、下游應用以及可用設備等因素。
純化後,可使用分光光度計或螢光儀對核酸進行定量,並使用凝膠電泳或其他方法評估其品質。純化後的核酸可用於下游應用,例如 PCR、測序或雜交分析。
蛋白酶 K 能降解與 DNA 結合的交聯蛋白,有助於從 FFPE 組織樣本中純化 DNA。
如何用蛋白酶 K 從 FFPE 組織樣本中分離核酸?
由於福爾馬林固定過程會造成蛋白質和核酸的交聯,因此從福爾馬林固定的石蠟包埋(FFPE)組織樣本中分離核酸可能會是一項挑戰。然而,蛋白酶 K 可用於消化蛋白交聯,並釋放出組織中的核酸。以下是使用蛋白酶 K 從 FFPE 組織樣本中分離核酸的一般程序概述:
1. 去石蠟:首先對 FFPE 組織樣品進行脫石蠟處理,以去除石蠟,使組織暴露,以便進行後續步驟。這可以使用二甲苯或其他有機溶劑完成。
2.重新水化:
3. 蛋白質消化:蛋白酶 K 被添加到重新水化的組織中,以消化蛋白質並釋放核酸。所需的蛋白酶 K 量會因組織類型和使用的組織量而異。一般而言,每毫升組織勻質液會使用 100-200 μg 的蛋白酶 K。
4.蛋白酶 K 的失活:蛋白消化後,蛋白酶 K 通常會在 95-100 °C 下加熱 10-15 分鐘來失活。這有助於確保蛋白酶 K 完全失活,不會干擾下游應用。
5.核酸純化:然後從蛋白酶 K 處理過的樣品中純化核酸。這可以用多種方法完成,包括酚-氯仿提取、柱式純化或磁珠式純化。純化方法的選擇取決於所需核酸的類型和數量、下游應用以及可用設備等因素。
純化後,可使用分光光度計或螢光儀對核酸進行定量,並使用凝膠電泳或其他方法評估其品質。然後,純化的核酸可以用於下游應用,例如 PCR、測序或雜交分析。
此方案有多種變異,具體細節可能因所分離的核酸類型和下游應用而異。然而,使用蛋白酶 K 消化是從 FFPE 組織樣本中分離核酸的許多方案中的常見步驟。
如何在血液 DNA 提取中使用蛋白酶 K。 如何在不同程序中使用蛋白酶 K。
如何找到最好的蛋白酶 K 供應商,請訪問 如何確定蛋白酶 K 的最佳產品和供應商。
如何大量訂購蛋白酶 K
針對您的特定應用,我們提供大容量和定制包裝尺寸的蛋白酶 K。請填寫表格,以獲得更多關於我們所提供產品的資訊。
Network error: Failed to fetch
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。