就 IMAC 而言,使用離子交換層析法進行重折疊涉及變性蛋白質的可逆固定。固定化可以防止在隨後的變性劑去除過程中發生聚集。組氨酸標記蛋白在 IMAC 媒介上的吸附條件基本上是通用的,但在離子交換媒介上的吸附條件則取決於目標蛋白的電荷特性。陽離子 (如 SP Sepharose) 和陰離子交換 (如 Q Sepharose) 媒介都已成功用於重折疊。與離子交換介質結合通常需要低離子強度條件(即低於 0.1)。在低 pH 值下會促進與陽離子交換樹脂的強結合,而在高 pH 值下會促進與陰離子交換樹脂的強結合。
使用陰離子交換和陽離子交換色譜法進行重折疊的示例分別如圖 3.7 和圖 3.8 所示。實驗可以用多種方式設計。在圖 3.7 中,在不同的實驗中,將回折緩衝液注入色譜柱,並停止流動 0 至 40 小時。在圖 3.8 中,使用遞減的尿素梯度進行再折疊。
一旦重折叠,如果需要更高的纯度,并在必要时去除聚集体,可以通过凝胶过滤等其他技术进一步纯化蛋白质。
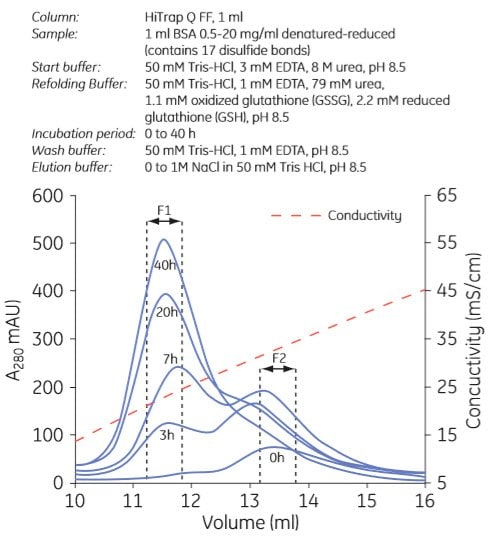
圖.3.7. 使用陰離子交換層析法重新折疊白蛋白。F1 含有重新折疊的蛋白質。經許可使用。版權所有 2005.Elsevier Science BV.
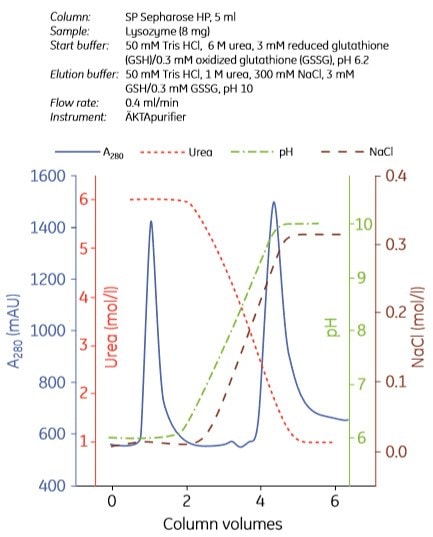
圖.3.8. 使用陽離子交換色層法重折溶菌酶。經許可使用。版權所有 2002.Elsevier Science BV.
表 3.8 列出了適用於重折疊的預包裝離子交換色譜柱。
| 柱 | 離子交換器類型 | 柱容量 | 動態結合容量 /mL 媒介 |
|---|---|---|---|
| HiTrap Q FF | 負離子交換器 | >100 mg HSA | |
| HiPrep 16/10 Q FF | 20 mL< | >100 mg HSA | |
| HiTrap Q HP | 70 mg BSA | ||
| HiLoad 16/10 and 26/10 Q Sepharose HP | 負離子交換 | 70 mg BSA | |
| HiTrap SP FF | 70毫克核糖核酸酶A | ||
| HiPrep 16/10 SP FF | 70 mg 核糖核酸酶 A | ||
| HiTrap SP HP | HiLoad 16/10 和 26/10 SP Sepharose HP | 55 mg 核糖核酸酶 A |
重折叠分析
重折叠实验结果的综合表征可包括生物活性测定,以及同质性和二级结构的物理化学表征(通常使用圆二色性)。
在許多情況下,特別是對於功能未知的蛋白質,這個表徵程序是不可能或不實際執行的。
使用凝膠過濾的均質性檢測通常足以作為重折疊是否成功的指標。與蛋白質預期分子量相對應的對稱峰表示重折已經發生。使用預封柱 Superdex 75 5/150 GL 和 Superdex 200 5/150 GL(表 3.9)可快速進行此分析。這些色譜柱可用於重折篩選實驗後的快速分析。
| 目標蛋白 Mr | 建議樣品容量 | Superdex 200 5/150 GL | 10 000-600 000 | 4-50 µL | 12 min < |
|---|---|---|---|---|---|
Superdex 75 5/150 GL | 3 000-70 000 3 000-70 000 | 4-50 µL | 12 min |
Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。