重組蛋白質最常在細胞內表達,但也可以控制表達,使蛋白質分泌到質周空間或分泌到培養基中。
然而,細胞內累積的重組蛋白經常以包涵體的形式沉積,包涵體是缺乏生物活性的錯誤折疊蛋白的不溶性聚集體。重組蛋白通常是包涵體的主要成分。因此,製備包涵體是非常重要的純化步驟。不過,從包涵體中分離蛋白質通常會導致重折疊的困難,而且通常無法完全恢復其生物活性。表 10.1 總結了使用以包涵體方式表達的重組產品的優缺點。真核蛋白在細菌宿主中表達時,常會形成包涵體。
如果蛋白以包涵體的形式表達,有幾個方案需要考慮:盡可能優化可溶性表達、接受包涵體的形成但制定策略來溶解和重折疊蛋白、嘗試另一種表達宿主或修改質粒結構。以包涵體形式表達可以表達對宿主細胞有毒的蛋白質。
優化可溶性表達
包涵體形成的原因還不是很清楚。
因此,為了優化可溶性表達,值得考慮對培養條件進行一些簡單直接的修改,以降低生長速度和/或表達速度。
降低生長溫度至 20 °C 至 30 °C 可降低生長速率。
對於在誘導啟動子控制下表達的蛋白質,也可以通過改變誘導條件來降低表達速率:
- 在較低的細胞密度下誘導(A600 = 0.5)
- 誘導時間較短
- 誘導時使用較低濃度的誘導劑(例如、0.1 mM IPTG)
如果這些修改證明不夠,可以考慮更全面的改變。這包括使用融合標籤,例如 GST 和麥芽糖結合蛋白 (MBP),據報導這些標籤可增強溶解度 (參考資料:Esposito, D. and Ch., 2009):Esposito, D. and Chatterjee, D. K. Enhancement of soluble protein expression through the use of fusion tags. Current Opinion Biotech, 17, 353-358 (2006)。其他選項包括與伴隨蛋白或其他折疊機械元件共表達,以及使用另一種宿主生物。全面描述增加可溶性表達的程序不在本手冊的範圍內。
溶解包涵體
如果培養改造不能顯著提高可溶性表達物的產率,則應考慮使用其他方法。
如果培養方法的改變不能顯著提高可溶性標記蛋白的產率,則可以使用普通的變性劑,如 4-6 M Gua-HCl、4-8 M 尿素、去垢劑、鹼性 pH (>9)、有機溶劑或 N-月桂基肌氨酸來溶解包涵體。
在有變性劑存在的情況下,能否成功地進行抗原純化取決於標記蛋白的性質。
對於每一種變性劑,增溶的成功率都會受到還原劑的存在和濃度、時間、溫度、離子強度以及變性劑與蛋白質的比例的影響。請參閱 表 10.2,以瞭解包涵體增溶的實驗起點。在這個階段,通常可以使用與變性劑相容的分離技術來純化溶解的蛋白質。純化和重折疊通常可以結合在同一個純化步驟中,例如透過色譜柱上重折疊。
已經發表了許多可替代的溶解協議(例如,REFOLD 資料庫)。選項包括使用 SDS (10%)、N-laurylsarcosine 或其他去垢劑和極端 pH。
溶解重組蛋白的重折疊
溶解後,蛋白必須適當地重折疊以恢復功能。必須移除變性劑,讓蛋白質重新折疊,並形成正確的分子內聯合。重新折疊過程中的關鍵參數包括 pH 值、還原試劑的存在(通常使用還原型和氧化型弱還原劑的混合物,例如、表 10.3比较了传统的重折叠方法和柱上纯化和重折叠方法。
重折叠通常需要大量的优化。例如,優化表達參數、製作新的構造或改變表達主機。
柱上重折叠
使用組組氨酸標記的蛋白質可以使用簡單而有效的純化和柱上重折叠程序,產生具有所需生物活性的可溶性蛋白質。圖 10.1 所示的方案已成功用於幾種不同的組氨酸標記蛋白。

圖 10.1.大腸桿菌細胞中以包涵體形式產生的(組氨酸)6-標記蛋白的提取、溶解和重折叠的一般方案。
組氨酸標記蛋白與固定化二價金屬離子的強結合不會被高濃度的混沌劑(如尿素或瓜-HCl)破壞。因此,(組氨酸)6標記蛋白可透過混沌萃取法溶出,並與 Ni Sepharose 結合。在蛋白質從柱中洗出之前,可透過交換到非變性緩衝條件來去除污染蛋白質和重新折疊。
一旦重新折疊,蛋白質就可以像任何原生蛋白質一樣,通過任何其他層析技術進一步純化(第 8 章,蛋白 A 標記蛋白的純化)。
分析正確折疊的蛋白質
表 10.4總結了用來評估蛋白質是否正確折疊的各種技術。
應用
使用HisTrap FF 1 mL和ÄKTAprime plus
從100 mL 大腸桿菌培養物中提取不溶性組氨酸標記蛋白質,並在柱上進行重折疊。大腸桿菌培養物,使用HisTrap FF 1 mL與ÄKTAprime plus
本程序使用HisTrap FF 1 mL色譜柱,但也可使用HisTrap HP 1 mL或HisTrap FF crude 1 mL色譜柱。
準備緩衝液
使用高純度的水和化學品,所有緩衝液在使用前通過0.45 µM的過濾器。
其他結合緩衝液:可在結合緩衝液中加入 5 至 40 mM 的咪唑,以減少非組氨酸標記蛋白的非特異性結合。咪唑的濃度取決於蛋白質,如果感興趣的蛋白質在某一咪唑濃度下洗脫或不結合,則降低濃度。
破壞、清洗和分離包涵體
- 將 100 mL 培養液中的細胞糊狀物重懸於 4 mL 重懸緩衝液中.
- 在冰上用聲波破壞細胞(例如、
- 在 4 °C下高速離心 10 分鐘。
- 移除上清液,將沉澱物重懸於 3 mL 冷分離緩衝液中。
- 在 4 °C下高速離心 10 分鐘。
- 重複步驟 4 和 5。
在此階段,可將顆粒材料在不含尿素的緩衝液中清洗一次,並冷藏以備日後處理。
溶解和樣品製備
- 用 5 mL 結合緩衝液重懸膠粒。
- 室溫攪拌 30 至 60 分鐘。
- 高速離心 15 分鐘,4 °C。
- 將樣品通過 0.45 µM 的過濾器。
β-巯基乙醇的最佳濃度(0 至 20 mM)必須根據每個蛋白質的情況進行實驗確定。
如果未按上述方法製備,則通過在結合緩衝液中稀釋或使用脫鹽柱進行緩衝液交換(第 11 章,脫鹽/緩衝液交換和濃縮),然後將樣品通過 0.45 µM 篩選器。
準備系統
如果選擇線性梯度形成進行重折疊和洗脫,使用色譜系統是必不可少的。
本範例使用 ÄKTAprime plus。
- 如上所述,將來自 A 端口(8 端口閥門)的各進口管置於洗出液中,將來自 B 端口(2 端口閥門)的管置於洗出緩衝液中。
- 將色谱柱連接至注射閥(7口閥)上的1號端口和UV流動池之間。
- 在分餾收集器架上裝滿18 mm的試管(最少40支),並將分餾臂上的白板對準第一支試管。
注意:如果需要 Superloop™,Superloop 使用说明中将提供更多信息。
選擇應用程式範本並啟動方法
- 檢查與 PrimeView 的通訊。螢幕右下角應該會顯示 Controlled By: prime 文字。
- 使用箭頭和 OK 按鈕在功能表樹中移動,直到找到On-Column Refolding HisTrap.
- 檢查與 PrimeView 的通訊。

3. 輸入樣品容量,然後按 OK 啟動模板。

圖 10.2.柱上折疊 HisTrap 應用範例的理論梯度

圖 10.3.組氨酸標記蛋白質的柱上折疊。
使用 IMAC 篩選重折疊條件
MultiTrap 96 孔板是篩選 IMAC 重折疊條件的有用產品(表 10.5)。在這個例子中,溶解的未折疊蛋白被分配到 His MultiTrap FF 孔中。蛋白在不同的重折疊緩衝液中孵育,並測定重折疊的程度(圖 10.4)。類似篩選實驗所得的最佳緩衝液可用於在 HisTrap FF 上擴大柱上折疊。
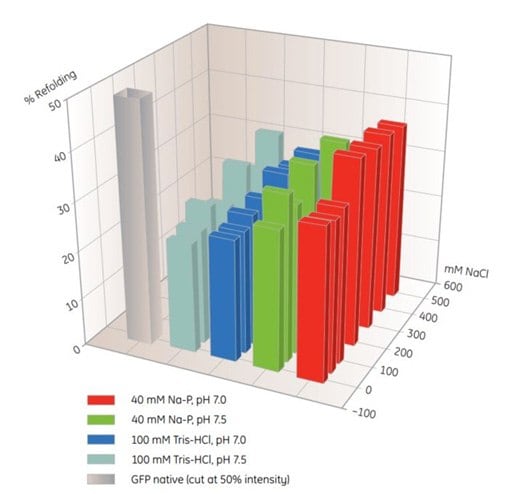
圖。10.4.使用 His MultiTrap™ FF 篩選組氨酸標記 GFP 的 IMAC 折疊條件。此初步篩選涵蓋緩衝物質、pH 值和鹽濃度。數據由德國慕尼黑工業大學的 J. Buchner、M. Haslbeck 和 T. Dashivets 慷慨提供。
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?