Glutathione S-transferase (GST) 是最常用的標記之一,用於促進重組蛋白的純化和檢測,有一系列產品可用於簡單的一步純化 GST 融合蛋白(請參閱純化選項)。
GST標記蛋白的純化和檢測,以及融合蛋白以包涵體形式表達時如何處理的資訊,在 GST基因融合系統手冊 和 重組蛋白手冊中有深入的論述:蛋白質擴增和簡易純化,可向 Cytiva 購買。
淨化選項 | |||
|---|---|---|---|
| 結合能力 | 最大操作流量 | 備註 | |
| 400 µg/column | n.a. | 即開即用、預先包裝的色譜柱、緩衝液和化學品。與 MicroPlex™ 24 Vacuum 搭配使用時,具有高通量 (最多可同時處理 48 個樣品)。 | |
| GSTrap FF 1 ml | 10-12 mg 重組 GST/色譜柱 | 4 ml/min | 預製色譜柱,即可使用。 |
| GSTrap FF 5 ml | 50-60 mg 重組 GST/色譜柱 | 15 ml/min | 製備好的色譜柱,即可使用。 |
| GSTPrep FF 16/10 | >;200 mg 重組 GST/色譜柱 | 10 ml/min | 預製色譜柱,即開即用。 |
| Glutathione Sepharose 4 Fast Flow | 10-12 mg 重組 GST/ml 培養基 | 450 cm/h* | 用於包裝高效能色譜柱,以配合純化系統及擴展使用。 |
| 8 mg 馬肝 GST/ml 培養基 | 75cm/h* | 用於包裝小柱和其他格式。 | |
* 請參閱附錄 4,將線性流量 (cm/h) 轉換為體積流量。最大工作流量是在床高 10 cm、內孔距 5 cm 的填料柱中測量計算出來的。
純化範例
圖 22顯示在 GSTrap FF 1 ml 上純化 GST 融合蛋白的典型過程,以及純化蛋白的 SDS-PAGE 分析。

圖 22.GST 融合蛋白的純化。
Figure 23展示了 GST 融合蛋白的純化如何從 GSTrap FF 1 ml 試劑柱擴大 20 倍至 GSTPrep FF 16/10 試劑柱。
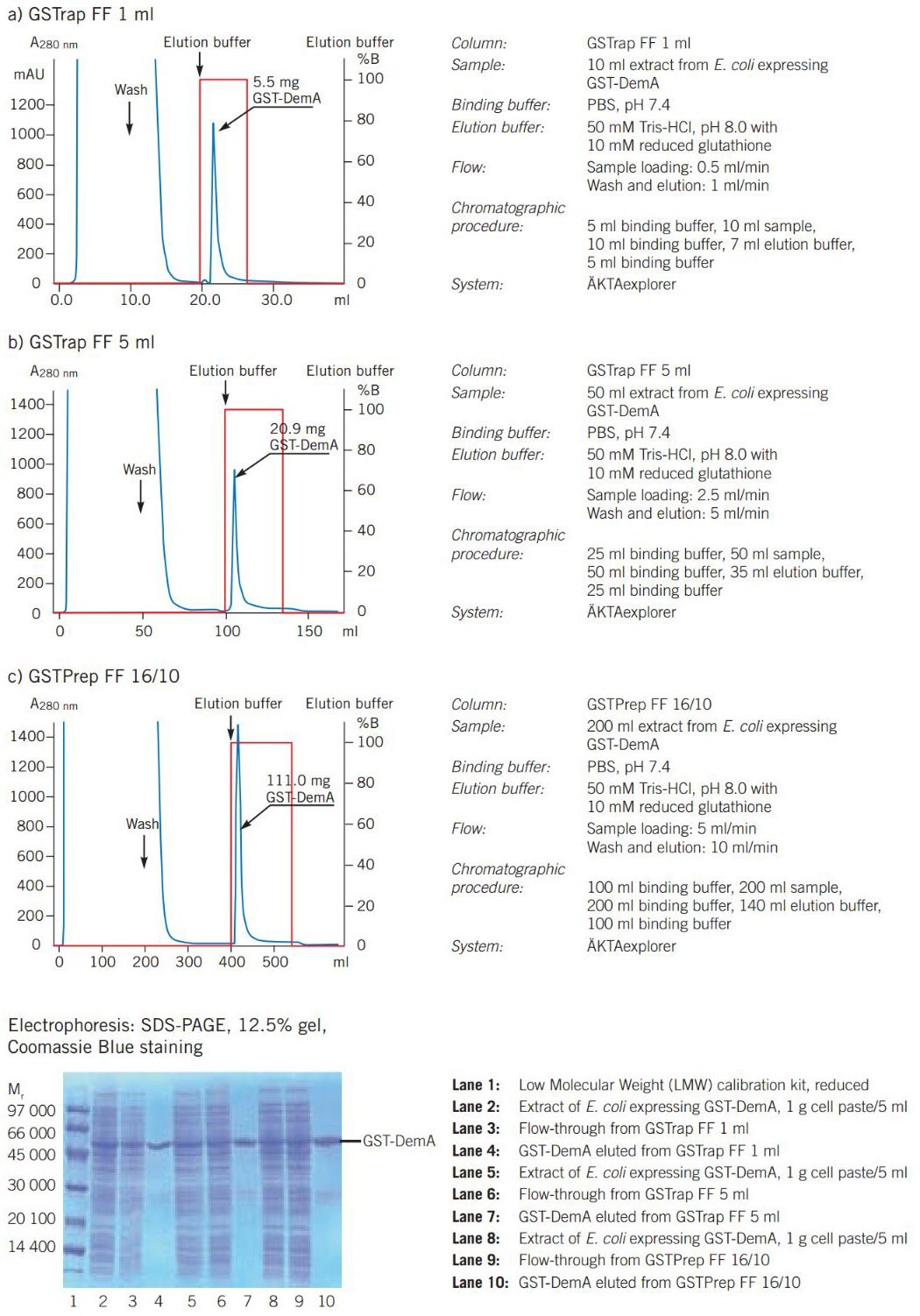
圖 23. 擴大 GST 融合蛋白的純化。
進行分離
結合緩衝液:140 mM NaCl、2.7 mM KCl、10 mM Na2HPO4、1.8 mM KH2PO4,pH 7.3
洗脱缓冲液:50 mM Tris-HCl、10 mM 還原型穀胱甘肽,pH 8.0

圖 24. 用注射器使用 GSTrap FF。 A:準備緩衝液和樣品。B:平衡色譜柱,載入樣品並開始收集馏分。 C:清洗和洗脫,繼續收集馏分。
- 用5-10柱容量的結合緩衝液平衡色譜柱。
- 用 5-10 個柱容量的結合緩衝液洗滌。
由於 GST 與穀胱甘肽之間的結合動力學相對緩慢,因此在上樣和洗脫過程中保持低流速非常重要。結合能力取決於蛋白質,因此產率會因蛋白質類型而異。
對於少量產品的單次純化或高通量篩選,GST MicroSpin 膠柱可與離心法或 MicroPlex 24 真空法配合使用,方便簡單。
若要增加容量,請串聯幾支 GSTrap FF 色譜柱(1 ml 或 5 ml)。如需更大容量,請使用 GSTPrep 16/10 FF 色譜柱或將 Glutathione Sepharose 4 Fast Flow 包裝到合適的色譜柱(見附錄 3, Column packing and preparation for affinity chromatography)。GSTrap FF 色谱柱可与注射器、蠕动泵或色谱系统配合使用。
通常包含酶特定识别位点,以便在需要时通过酶裂解去除 GST 标记。凝血酶通常用於酵素裂解,其後必須從重組產品中移除。HiTrap 苄脒 FF(高次)1 ml 或 5 ml 色谱柱为这一过程提供了简单、现成的解决方案(参见第 54 页, Purifcation or removal of serine proteases, e.g. thrombin and trypsin, and zymogens).
GSTrap FF 的重复使用取决于样品的性质。為了防止交叉污染,色譜柱只能用相同的樣品重複使用。
清洗
這些步驟適用於 Glutathione Sepharose 4 Fast Flow 和 Glutathione Sepharose 4B。
- 用 2-3 柱容量的高 pH 值(0.1 M Tris-HCl,0.5 M NaCl,pH 8.5)和低 pH 值(0.1 M 醋酸鈉,0.5 M NaCl,pH 4.5)缓冲液。
- 重复循环 3 次。
- 立即用 3-5 柱体积的结合缓冲液重新平衡。
如果培養基失去結合能力,可能是由於沉澱的蛋白質、變性蛋白質或非特異性結合蛋白質的堆積。
去除疏水性結合物質:
- 用 3-4 柱容量的 70% 乙醇(或 2 柱容量的非離子洗滌劑 (Triton™ X-100 1%) )清洗。
- 立即用 5 柱容量的結合緩衝液清洗。
媒體特性 | ||||
|---|---|---|---|---|
| 墊臂 | 配體和密度 | pH穩定度* | 平均粒徑 | |
| 谷胱甘肽分離膠 4 Fast Flow (GSTrap FF, GSTPrep FF 16/10) | 10 碳鏈結 | 短期 3-12 長期 3-12 | 90 µm | |
| Glutathione Sepharose 4B | 10 carbon linker | 短期 4-13 長期 4-13 | 90 µm | |
化學穩定性
在室溫下暴露於 0.1 M 檸檬酸鹽 (pH4.0)、0.1 M NaOH、70% 乙醇或 6 M 鹽酸胍中 2 小時,結合能力無明顯損失。
儲存
在中性pH值下,用20%乙醇清洗培養基和色譜柱(使用約5個色譜柱容量來包裝培養基),並儲存於+4至+8 °C.
。Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。