在流式細胞計測試的關鍵步驟中,一些微小的細節都可能對所得數據產生重大影響。大多數流式細胞計測方案都有四個步驟:
樣本製備
任何可以製成單個細胞懸液的細胞群都可以用流式細胞計來評估。以下三點是需要考慮的重點:
- 為了準備體外細胞群,通常會使用機械解離方法將新鮮解剖的組織輕輕均質化,然後透過密度梯度離心將不同類型的細胞分離,以去除細胞內的基質材料、碎屑和不相干的細胞群。
- 必須注意的是,在使用前,必須使用酵素溶液或鈣螯合試劑使黏附的細胞從細胞培養容器表面脫離。
- 懸浮的細胞培養物只需要計數和評估其存活率。
細胞計數/計數器指的是懸浮液中的存活細胞,可使用自動細胞計數器進行測定,並應用閘門排除死細胞/碎片。另外,也可以使用顯微鏡輔助計算已知體積中的活細胞數量,例如使用血球計和 Trypan 藍染料來評估存活率,活細胞的完整膜會排除這種染料,只有無法存活的死細胞才會吸收這種染料。
阻斷
為防止一抗與懸浮細胞的非特異性結合,可使用抗 Fc 抗體稀釋液(針對樣本種類)。這可以防止抗體的 Fc 或常數區域與 Fc 受體結合,而 Fc 受體存在於大多數的細胞類型中。Fc 阻斷劑通常以小劑量加入洗淨的細胞中。染色抗體稀釋液會在阻斷孵育結束時立即加入,而不需要水洗步驟。這可確保在整個過程中保持阻斷非特異性抗體結合。
抗體孵育
初級抗體孵育
與其他以抗體為基礎的應用不同,例如免疫組織化學,流式細胞儀的抗體稀釋通常不是以每容積緩衝液的抗體質量為基礎,而是以樣本中每細胞數量的抗體質量為基礎。與其他應用一樣,最佳濃度必須根據經驗決定。抗體可在流式細胞計測試緩衝液中稀釋。以小劑量進行染色可使抗體更容易接觸到懸浮的細胞。
二抗孵育
如果採用間接檢測技術,一抗孵育後應與適當稀釋的二抗孵育,二抗與所用一抗的同工型具有特異性。在多色檢測實驗中,必須為每個第二抗體選擇足夠不同波長或顏色的螢光團,以區分來自每個目標的信號。與第二抗體的孵育必須在黑暗中進行,以保護對光敏感性的螢光體,並且和之前一樣,樣品應保持在冰上,並在 4°C 離心。
螢光染料
流式細胞計中使用的許多抗體都直接與螢光染料結合;然而,許多未標示的一抗也常與標示的二抗結合使用。流式細胞計中最常用的兩種螢光染料是異硫氰酸螢光素 (FITC) 和藻紅蛋白 (PE)。這兩種染料使其成為首選標籤的兩個關鍵特性是,它們都能被 488 奈米的雷射激發,而且它們的發射光譜截然不同,FITC 在 530 奈米(綠色),而 PE 則在 570 - 575 奈米(橘色)。螢光顏料化學與流式細胞儀器的進步,使多種細胞同時標記與分選的可能性超越了原本的兩種染料。

圖 1.FluoroFinder® Spectra Viewer 輸出各種螢光團的激發與發射波長。從左至右依序為 mFluor 450、Alexa Fluor 488、PE、APC、iFluor 700 及 iFluor 750。
在任何特定的流式細胞計實驗中,可檢查的變量的最大數量取決於可用光源和檢測器的數量。具有多個雷射的流式細胞儀讓研究人員有能力同時使用不共享相同激發光譜的螢光團,擴大了可使用的抗體數量。
選擇適當螢光染色體的提示:
- 針對您的儀器配置選擇最亮的螢光染色體。
- 根據儀器配置,選擇螢光色素以減少光譜重疊。
- 為較弱的抗體保留最亮的螢光色素,反之亦然。
- 避免明亮的細胞群溢出到對這些細胞群要求高靈敏度的檢測器中。
- 避免串聯染料降解,並考慮其對結果的影響。
若要瞭解更多關於選擇適當螢光染料的資訊,請參閱我們關於 選擇適合您的螢光染料的指南。為多色流式細胞分析建立最佳面板。
固定和儲存
一旦完成表面抗原染色,可將細胞固定在磷酸盐缓冲液中的多聚甲醛中,而不是重新悬浮進行採集。當染色後無法立即取得樣本時,此方法很有用,因為它可讓細胞在 4°C 儲存過夜。之後,固定液應稀釋,細胞至少洗滌兩次。儘管建議在染色後立即取得樣本,但已在 4°C 儲存且避光的固定細胞可在固定後 48 小時內取得樣本:細胞通透化
當感興趣的蛋白是細胞內的,表面染色後的細胞固定是必要的,以增加結構強度,使細胞能承受隨後的通透化,讓抗體進入細胞內抗原。經固定及水洗後的細胞,可在室溫下與適當的洗滌劑在磷酸鹽浴鹽水中孵育不超過 15 分鐘,再稀釋洗滌劑溶液並水洗一次,以達到透化的目的。建議使用非離子洗滌劑,例如皂素。在涉及抗體或鏈霉親和素的所有步驟中,都必須保持通透性,而要做到這一點,可在染色緩衝液中加入去垢劑,以貫穿後續染色直至螢光體孵育步驟。使用流式細胞計法檢測細胞內抗原也遵循上述原則和程序,可以是直接、間接或直接/間接加信號增強。
資料擷取
目前大多數的流式細胞儀都附有必要的軟體,用來擷取和轉換每個細胞經過偵測器時粒子特徵所產生的訊號。這些軟體程式通常包含有助於組織實驗的元件,這項功能在分析來自多個樣本的各種樣品時尤其重要。
對於多色實驗,設定補償參數是很重要的,因為可以確認實驗中使用的各種螢光團光譜之間的波長重疊。補償會校準每個螢光團的光譜,並允許減去相鄰通道因光譜重疊而產生的信號。
如果您的實驗無法得到高品質的結果,請參閱我們的 Flow Cytometry Troubleshooting Guide 以獲得解決常見問題的技巧。

圖 2. 此雙參數流式細胞計圖顯示如何利用細胞的光散射特性來識別有興趣的細胞群,此處是根據其大小(前向散射)和細胞內複雜性(側向散射)來識別。然後,使用者可使用閘門或定義與應用的區域來識別有興趣的子群(在此,紅色橢圓標示可能存活的群體),以便進行重點分析。
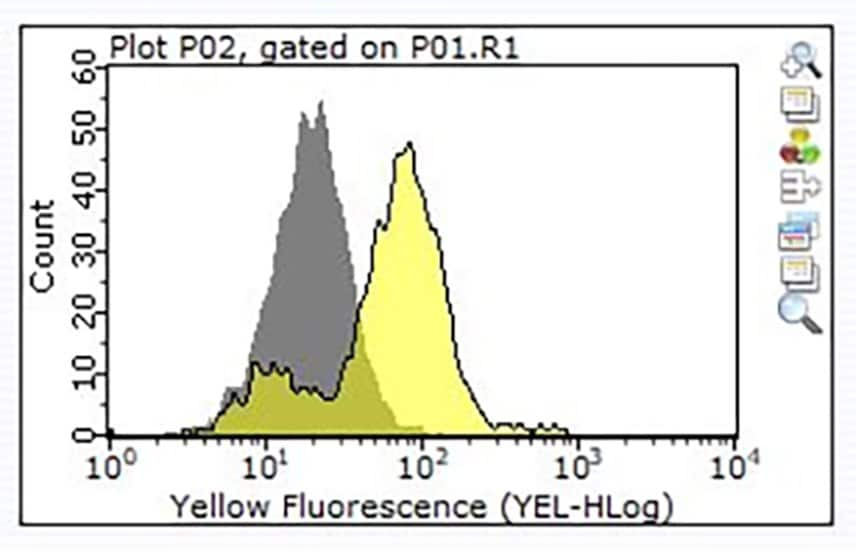
圖 3. 使用 1 μg 的產品編號 ZRB1564、Anti-CD24、clone 3N22 ZooMAb® 兔單株抗體 (黃色直方圖) 或等量的兔 IgG 異型對照 (灰色直方圖),接著使用 PE 結合的驢抗兔 IgG 二抗,對一百萬個 Raji 細胞進行染色。
Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。