Solidne różnicowanie ludzkich iPSC w specyficzne dla linii neurony i komórki glejowe z wykorzystaniem podwójnej inhibicji SMAD
Nick Asbrock, Christine Chen, Vi Chu
Wprowadzenie
Odkrycie, że komórki somatyczne mogą zostać przekształcone w indukowane pluripotencjalne komórki macierzyste (iPS) z ekspresją czterech czynników transkrypcyjnych (Oct-4, Klf-4, Sox-2 i c-Myc) stworzyło nowy, ekscytujący obszar badań nad komórkami macierzystymi1. Wiele ludzkich chorób, dla których wcześniej brakowało kompleksowego modelu komórkowego in vitro, można obecnie modelować za pomocą komórek iPS pochodzących od pacjentów. Choroby neurologiczne, takie jak choroba Alzheimera, choroba Parkinsona i autyzm, były jednymi z pierwszych chorób modelowanych przy użyciu komórek iPS. Wysoce wzbogacone i skalowalne neuronalne komórki progenitorowe (NPC) pochodzące z komórek iPS są atrakcyjną alternatywą dla izolowanych tkankowo komórek pierwotnych i unieśmiertelnionych linii neuronalnych komórek macierzystych w badaniach biomedycznych. Te pochodzące z komórek iPS NPC oferują ekscytującą możliwość badania rozwoju neuronów i zaangażowania w określone typy komórek nerwowych bez obaw etycznych związanych z wykorzystaniem ludzkich embrionalnych komórek macierzystych.
Podwójne hamowanie SMAD jest dobrze ugruntowaną metodą pozyskiwania neuronalnych komórek progenitorowych zarówno z ludzkich komórek ES, jak i iPS2. Protokół ten wykorzystuje dwa inhibitory SMAD, Noggin i SB431542, do szybkiego różnicowania komórek ES/iPS w wysoce wzbogaconą populację NPC2. Noggin działa jako inhibitor BMP, a SB431542 hamuje szlaki Lefty/Activin/TGFβ poprzez blokowanie fosforylacji receptorów ALK4, ALK5 i ALK7. Starając się stworzyć bardziej zdefiniowany i zoptymalizowany protokół różnicowania neuronów, Li i współpracownicy zmodyfikowali oryginalny protokół, aby ustanowić metodę różnicowania całkowicie opartą na małych cząsteczkach, która opiera się na trzech małych cząsteczkach hamujących szlaki sygnałowe GSK-3β (CHIR99021), TGFβ (SB431542) i Notch (związek E), wraz z ludzkim LIF3. Ten nowy protokół różnicowania neuronalnego oparty na małych cząsteczkach zwiększył kinetykę różnicowania neuronalnego i umożliwił wyprowadzenie prawdziwie multipotencjalnych neuronalnych komórek macierzystych, które reagują na regionalne sygnały wzorcowe określające podtypy neuronalne i glejowe przodomózgowia, śródmózgowia i tyłomózgowia.
Łącząc wyżej opisane metodologie, opracowaliśmy nową pożywkę do indukcji neuronów (NIM) i pożywkę do różnicowania neuronów (NDM), aby skutecznie wytwarzać rozety neuronalne, rozszerzalne progenitory neuronalne, końcowe podtypy neuronalne (glutaminergiczne i dopaminergiczne) i glejowe (oligodendrocyty) z ludzkich komórek ES/iPS. Podłoża te opierają się na kombinacji powszechnie stosowanych suplementów neuronalnych wraz z kombinacjami inhibitorów małych cząsteczek w celu uzyskania wysoce wzbogaconej populacji multipotencjalnych NPC. Wiele raportów wykazało skłonność NPC do różnicowania się w kierunku jednej linii, głównie neuronalnej lub glejowej, ale nie obu. Korzystając z naszych nowo opracowanych pożywek NIM i NDM, populacje NPC pochodzące z komórek iPS dobrze reagowały na odpowiednie indukcyjne sygnały wzorcowe i mogły być kierowane zarówno do linii komórek nerwowych, jak i glejowych.

Rysunek 1.Przepływ pracy pokazujący wszystkie etapy generowania komórek iPS i późniejszego różnicowania do linii neuronalnych i glejowych. W zaledwie czterech krokach dorosłe fibroblasty można przekształcić w linie neuronalne i glejowe przy użyciu preparatów pożywek do modulowania losu komórek.
Metody
.Neuronalne różnicowanie iPSCs przy użyciu mediów do indukcji neuronów
Neuronalne komórki progenitorowe i zróżnicowane komórki neuronalne pochodzące z komórek iPS zostały wygenerowane przy użyciu zestawu Human ES/iPS
Cell Neurogenesis (SCR603). Niezróżnicowane kolonie komórek iPS wysiewano na komórki MEF na 48 godzin z 20% pożywką KOSR uzupełnioną o FGF-2, 8 ng/ml (F0291). Po 48 godzinach pożywkę wzrostową zastąpiono pożywką do indukcji neuronów 1 (NIM1) przez pięć dni z pożywką zmienianą co drugi dzień. Szóstego dnia komórki dysocjowano za pomocą buforu nieenzymatycznego (S-004-C) i umieszczano na 0,5 mg/ml Matrigelu® płytkach z pożywką do indukcji neuronów 2 (NIM2) przez dodatkowe pięć dni z pożywką zmienianą co drugi dzień. Po 10 dniach neuronalne komórki progenitorowe zebrano za pomocą odczynnika Accutase® (A6964) i ekspandowano z użyciem pożywki ENStem™-A (SCM004) z dodatkiem 20 ng/ml FGF-2 i 2 mM glutaminy na kolbie lub płytkach pokrytych 0.1 do 0,2 mg/ml Matrigelu® przy gęstości 0,5 do 1 x 105 komórek/cm2.
Różnicowanie neuronalnych komórek progenitorowych w neurony
Neuronalne komórki progenitorowe w wieku od P3 do P8 zebrano za pomocą odczynnika Accutase® (A6964), a NPC umieszczono na poli-L-ornitynie/lamininie, 10 μg/mL każda (P4957; CC095) w ilości od 10 do 20 tysięcy komórek/cm2 z pożywką do różnicowania neuronów (SCM111) z dodatkiem 0,5 mM dibutyrylu cAMP i 0,2 mM fosforanu kwasu askorbinowego. Około 80% pożywki było odświeżane co dwa do trzech dni przez łącznie 9-14 dni. Komórki utrwalono 2% paraformaldehydem przed barwieniem immunofluorescencyjnym. Procent zróżnicowanych komórek określono na podstawie oceny wizualnej.
Różnicowanie neuronalnych komórek progenitorowych w neurony dopaminergiczne
W celu uzyskania neuronów dopaminergicznych, zestaw Dopaminergic Differentiation Growth Factor Sampler (SCR128) został włączony do protokołu neurogenezy opartego na NIM. Do pożywki NIM2 dodano 200 ng/ml sonic hedgehog i 100 ng/ml FGF-8, a komórki hodowano przez pięć dni. Następnie komórki zebrano za pomocą odczynnika Accutase® do pojedynczych komórek i 3 x 104 NPC umieszczano na płytkach pokrytych poli-L-ornityną i lamininą w stężeniu 10 μg/ml każda z pożywką do różnicowania neuronów zawierającą 20 ng/ml BDNF i GDNF oraz 1 ng/ml TGFβIII przez 14 dni. Komórki dodatnie pod względem hydroksylazy tyrozynowej reprezentujące neurony dopaminergiczne scharakteryzowano za pomocą barwienia immunofluorescencyjnego.
Różnicowanie neuronalnych komórek progenitorowych w oligodendrocyty
Różnicowanie oligodendrocytów z komórek iPS przeprowadzono poprzez hodowlę neuronalnych komórek progenitorowych w P1 w zawiesinie z pożywką do ekspansji oligodendrocytów (SCM107, pożywką podstawową z PDGF-AA, NT3, FGF2, T3) i kwasem retinowym przez 14 dni. Neurosfery glejowe były następnie umieszczane na płytkach pokrytych poli-L-ornityną i lamininą w stężeniu 10 μg/mL każda w celu dalszego dojrzewania w podłożu Human OPC Spontaneous Differentiation Media (SCM106) przez 14 dni, ze zmianą podłoża co dwa do trzech dni.
Region-specyficzne wzorcowanie neuronalnych komórek progenitorowych
Komórki iPS indukowano do linii neuronalnych zgodnie z opisem w podręczniku użytkownika NIM. W piątym dniu komórki hodowano przez kolejne 10 dni w NIM2 (w celu spontanicznego różnicowania), NIM2 zawierającym 200 ng/ml sonic hedgehog i 100 ng/ml FGF8 (SHH/FGF8; w celu przygotowania komórek do losu śródmózgowia) lub 200 ng/ml sonic hedgehog i 1 μM kwasu retinowego (SHH/RA; w celu przygotowania komórek do losu przodomózgowia). Po 10 dniach komórki zebrano, a wzór ekspresji genów przeanalizowano za pomocą qRT-PCR. Do normalizacji ekspresji genów między próbkami użyto GAPDH. Krotne zmiany w ekspresji genów obliczono na podstawie wartości ΔCt (znormalizowanych do GAPDH) i znormalizowano do próbki spontanicznej (spontanicznej, n = 2).
Wyniki
Ponad 80% Pax6-dodatnich, spolaryzowanych rozet neuronalnych zostało wygenerowanych z Oct-4-dodatnich ludzkich komórek iPS przy użyciu mediów NIM1 i NIM2 po 10 dniach różnicowania. Ekspresja Pax6 wzrosła już po 5 dniach, podczas gdy dojrzałe struktury rozet neuronalnych, wyrażające zarówno Pax6, jak i N-kadherynę, zaobserwowano po 10 dniach hodowli. Rozety neuronalne można było oddzielić i rozszerzyć do 10 pasaży na naczyniach hodowlanych pokrytych Matrigel® w pożywce ekspansyjnej ENStem™-A, zachowując wysoki poziom ekspresji Sox-2, Nestin i N-kadheryny.
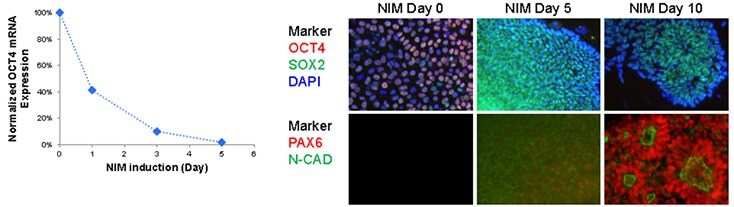
Rysunek 2.Neuronalne różnicowanie iPSC A) Szybka regulacja w dół pluripotencjalnego producenta, OCT4, w protokole NIM. Ekspresja Oct4 została drastycznie obniżona już 24 godziny po indukcji neuronalnej. B) Zwiększona regulacja czynników neuronalnych w protokole NIM. Ekspresja Oct4 zmniejszyła się po 5 dniach NIM, podczas gdy ekspresja Sox2 wykazała umiarkowany wzrost podczas indukcji neuronalnej. Markery neuronalne, PAX6 i N-kadheryna są regulowane w górę po 10 dniach, tworząc spolaryzowane struktury rozet neuronalnych.

Rysunek 3.Charakterystyka neuronalnych komórek progenitorowych pochodzących z iPSC. Komórki NPC wyprowadzone z komórek iPS przy użyciu NIM wykazują typową morfologię progenitorów neuronalnych (A) i zostały wybarwione na markery NPC, Sox-2, N-kadherynę (B), Pax6 i Nestin (C). Komórki te mogą być ekspandowane przez 10 pasaży przy zachowaniu ekspresji Nestin i Sox-2.
Progenitory neuronalne pochodzące z komórek iPS były dalej różnicowane w terminalnie zróżnicowane neurony przy użyciu pożywki do różnicowania neuronów (NDM). Ponad 70% zróżnicowanych komórek było pozytywnych dla TUJ1 i MAP2, markerów dojrzałych neuronów, podczas gdy mniej niż 20% zróżnicowanych komórek było pozytywnych dla GFAP, markera astrocytów. Ostatecznie zróżnicowane komórki neuronalne były preferencyjnie glutaminergiczne (VGlut+), a nie neurony GABAergiczne (GAD65 -) przy użyciu NDM.

Rysunek 4.Neuronalne różnicowanie NPC pochodzących z iPSC. Po 9 dniach różnicowania komórki wykazywały rozszerzone, rozbudowane sieci neurytów. Większość zróżnicowanych komórek wyrażała markery neuronalne, TUJ1 i MAP2 (A), a niektóre komórki różnicowały się w astrocyty GFAP+. (B). Ostatecznie zróżnicowane komórki były raczej neuronami glutaminergicznymi (C) niż GABAergicznymi (D).
Zarówno progenitory neuronalne pochodzące z komórek ES, jak i iPS mogą być kierowane do różnicowania się w neurony dopaminergiczne z dodatnią hydroksylazą tyrozynową przy użyciu NDM i kombinacji czynników wzrostu (SCR128; SHH, FGF8, BDNF, GDNF i TGFβIII). 10-30% zróżnicowanej populacji kultur było dodatnich pod względem hydroksylazy tyrozynowej po 14 dniach różnicowania.
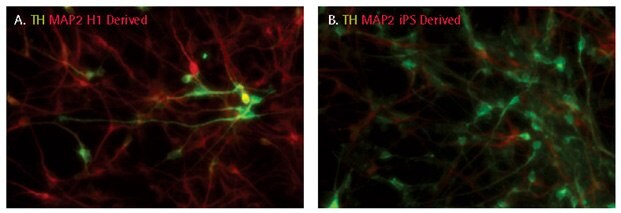
Rysunek 5.Różnicowanie dopaminergiczne NPC pochodzących z iPSC. Po 14 dniach różnicowania, neurony dopaminergiczne zostały scharakteryzowane poprzez śledzenie ekspresji hydroksylazy tyrozynowej (TH). 10-30% komórek było pozytywnych dla hydroksylazy tyrozynowej.
Ludzkie komórki NPC pochodzące z komórek iPS mogły skutecznie różnicować się w linię glejową przy użyciu zastrzeżonego protokołu różnicowania oligodendrocytów. Zróżnicowana populacja była w 80% pozytywna pod względem markerów oligodendrocytów A2B5, O4 i Sox10, w 10% pozytywna pod względem GFAP i w 30% pozytywna pod względem GalC.

Rysunek 6.Różnicowanie oligodendrocytów NPC pochodzących z komórek iPS. Komórki hodowano jako neurosfery w pożywce do ekspansji oligodendrocytów i małych cząsteczek przez 14 dni przed umieszczeniem na płytkach pokrytych poli-L-ornityną i lamininą w celu przeprowadzenia analiz immunocytochemicznych dla A2B5 (A), O4 (B), Sox10 (C), TUJ1 i GFAP (D), NG2, GalC (E), Sox-2 i Nestin (F). Ponad 80% komórek było A2B5-, O4- lub Sox10-pozytywnych, 10% GFAP-pozytywnych i 30% pozytywnych dla GalC.
Ludzkie NPC pochodzące z komórek iPS można było modelować w neurony śródmózgowia, przodomózgowia lub tyłomózgowia przy użyciu NDM i specyficznych induktorów modelowania (SHH/FGF8 lub SHH/kwas retinowy). Pomyślne wzorcowanie określono za pomocą qRTPCR do pomiaru ekspresji markerów specyficznych dla regionu.

Rysunek 7.Specyficzne dla regionu różnicowanie neuronów NPC. Komórki iPS pochodzące od STEMCAA™ indukowano do linii neuronalnych zgodnie z opisem. W dniu 5 komórki hodowano w NIM2 (spontanicznie) lub NIM2 z 200 ng/ml sonic hedgehog, 100 ng/ml FGF8 (SHH/FGF8) lub 200 ng/ml sonic hedgehog, 1μM kwasu retinowego (SHH/RA) przez 10 dni, aby przygotować komórki odpowiednio do losu śródmózgowia i tyłomózgowia. Po 10 dniach komórki zebrano, a wzór ekspresji genów przeanalizowano za pomocą qRT-PCR.
Wnioski
Opracowaliśmy nową, wydajną pożywkę do indukcji i różnicowania neuronów w celu generowania wysoce ekspansywnych i multipotencjalnych progenitorów neuronalnych oraz końcowych komórek neuronalnych i glejowych z komórek iPS. Pożywki te wykorzystują uznane inhibitory drobnocząsteczkowe i suplementy pożywek neuronalnych w celu uzyskania szybkiej kinetyki i wydajności różnicowania. Pokazujemy, że NPC pochodzące z komórek iPS mogą być ekspandowane do 10 pasaży przy zachowaniu odpowiedniej kinetyki wzrostu i ekspresji markerów. Te NPC są multipotencjalne, różnicując się w neurony, astrocyty i oligodendrocyty w zależności od czynników środowiskowych wprowadzonych do warunków hodowli. Specyficzne podtypy neuronalne, takie jak neurony dopaminergiczne TH+ i glutaminergiczne VGlut+, mogą być również generowane z NPC przy użyciu powszechnie stosowanych czynników indukujących wzrost. Pożywki te stanowią kompletne rozwiązanie dla naukowców chcących modelować choroby neurologiczne, takie jak choroba Alzheimera, choroba Parkinsona i autyzm, przy użyciu systemu modelowego komórek iPS.
Materiały
Network error: Failed to fetch
Network error: Failed to fetch
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.