Funkcjonalne polimery RAFT do zastosowań biomedycznych
M. Shahinur Rahman, Sebastian Grajales
Material Matters, 2016, 8.3, 96
Wprowadzenie
Polimeryzacja z odwracalną addycją i fragmentacją łańcucha (RAFT) szybko wysuwa się na pierwszy plan w konstrukcji nośników leków i genów. Technika RAFT pozwala na bezprecedensową swobodę w syntezie rozpuszczalnych w wodzie lub amfifilowych architektur o precyzyjnych wymiarach i odpowiedniej funkcjonalności do przyłączania i ukierunkowanego dostarczania środków diagnostycznych i terapeutycznych. Do tej pory wysiłki koncentrowały się na wykorzystaniu polimeryzacji RAFT do generowania miceli kopolimerów blokowych, pęcherzyków, polimerów gwiaździstych, nanocząstek i kapsułek jako potencjalnych zaawansowanych nośników leków, a także koniugatów polimer-lek jako proleków (Rysunek 1).1 Niniejszy przegląd koncentruje się na przeglądzie procesu RAFT, wyborze odpowiednich czynników RAFT i jego potencjale do budowy dostosowanych do potrzeb (blokowych) kopolimerów, polimerów funkcjonalnych i polimerów o szerokim zakresie rozpoznawania biologicznego.

Rysunek 1.Przykłady systemów kontrolowanego uwalniania leków generowanych przez polimery RAFT: zespoły supramolekularne, w tym micele, pęcherzyki i gwiazdy; nanocząstki, mikrocząstki i kapsułki; oraz koniugaty polimer-lek. Dostosowane z Liu, et al., Odnośnik 1.
Polimeryzacja rodnikowa
Techniki kontrolowanej polimeryzacji rodnikowej (CRP) zostały wcześniej omówione w artykułach,2,3 książkach,4 i przewodniku.5 Techniki te polegają na szybkim ustaleniu równowagi między aktywnym, propagującym się łańcuchem polimerowym a uśpioną cząsteczką. Proces RAFT generuje polimery o precyzyjnie kontrolowanych parametrach strukturalnych, takich jak kopolimery losowe, blokowe, gradientowe, szczepione i gwiaździste.6-9 Zalety polimeryzacji RAFT obejmują możliwość pracy w szerokim zakresie warunków reakcji i rozpuszczalników. W polimeryzacji RAFT, czynniki transferu łańcucha (powszechnie określane jako CTA lub czynniki RAFT) tworzą odwracalną równowagę addycji/fragmentacji (Schemat 1). W tym procesie początkowa generacja rodnika wytwarza propagujący się łańcuch polimerowy. Ten łańcuch polimerowy (w idealnym przypadku) szybko zareaguje z czynnikiem RAFT, który sfunkcjonalizuje koniec łańcucha ugrupowaniem RAFT, powodując w ten sposób uśpienie. Pozostała część cząsteczki oryginalnego czynnika RAFT zainicjuje następnie nowy drugi łańcuch polimerowy. Ten drugi łańcuch ostatecznie zareaguje z łańcuchem polimerowym funkcjonalizowanym przez RAFT, tworząc środowisko, w którym łańcuchy polimerowe są na przemian uśpione i aktywne, a zatem rosną w podobnym tempie. Idealnie daje to łańcuchy polimerowe o porównywalnej długości.
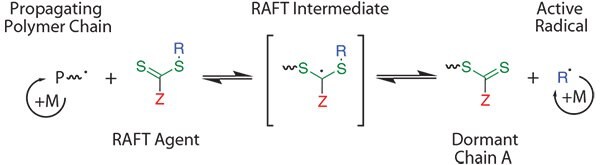
Schemat 1.Uproszczony mechanizm polimeryzacji RAFT. Zasadniczo rodnik (w postaci propagującego się łańcucha polimerowego) reaguje z czynnikiem RAFT, który może odwracalnie fragmentować, tworząc nowy aktywny rodnik (w kolorze niebieskim). Gdy rodnik reaguje z pobliskimi jednostkami monomeru, "R" będzie reprezentować drugi propagujący się łańcuch polimerowy. Powoduje to, że grupa tiokarbonylotio (w kolorze zielonym) przenosi się z łańcucha na łańcuch, działając jako "grupa ochronna". Grupa Z (w kolorze czerwonym) dyktuje, które typy monomerów można skutecznie kontrolować.
Chociaż RAFT jest wszechstronny i istnieją czynniki RAFT dostępne dla szerokiej gamy monomerów, ograniczeniem RAFT jest to, że nie ma jednego czynnika RAFT zdolnego do kontrolowania wszystkich typów monomerów. Aby uzyskać pożądany poziom kontroli polimeryzacji, środki RAFT muszą być wybierane w oparciu o odpowiedni typ monomeru. Wcześniej opublikowane tabele kompatybilności pomagają w tym wyborze,5 a wiele odmian funkcjonalizowanych środków RAFT jest dostępnych w handlu. Ogólnie rzecz biorąc, istnieją cztery rodzaje środków RAFT, z których wszystkie zawierają ugrupowanie tiokarbonylotio (Schemat 1). Środki RAFT, takie jak ditioestry10 i tritiowęglany11 dobrze sprawdzają się w kontrolowaniu polimeryzacji "bardziej aktywnych" monomerów (MAM), takich jak styren (Sty), akrylan metylu (MA) i metakrylan metylu (MMA), podczas gdy ditiokarbaminiany12,13 i ksantany14 muszą być stosowane do kontroli polimeryzacji "mniej aktywowanych" monomerów (LAMs). monomerów (LAM), takich jak octan winylu (VAc), N-winylopirolidon (NVP) i N-winylokarbazol (NVC). Niewłaściwe łączenie w pary (np, ditiokarbaminianowy środek RAFT z monomerem MMA) będzie hamować lub znacznie ograniczać polimeryzację.11 Próbując temu zaradzić, istnieją środki RAFT przełączalne pH (takie jak produkt nr. 736236) zdolne do generowania poli(MAM)-blok-poli(LAM).15
Środki RAFT o szczególnym znaczeniu dla dostarczania leków i genów pozwalają na łatwą koniugację przed lub po polimeryzacji ze związkami biologicznymi. W szczególności środki RAFT zawierające kwas karboksylowy (nr produktu 723010 oraz 722995), azydek (nr produktu. 741698), ester NHS (Product No. 741035 ), ester pentafluorofenylowy (Product No. 740810), alkiny (Product No. 765147) i grupy końcowe talimido (Product No. 777072) i grupy fotoklektywne (Product No. 765147). (Rysunek 1) są obecnie komercyjnie dostępne do syntezy dobrze zdefiniowanych homopolimerów i kopolimerów do konkretnych zastosowań biomedycznych.
Funkcjonalne polimery RAFT do biokoniugacji
Biokoniugaty polimerów winylowych są coraz częściej stosowane w biomedycynie, biotechnologii i nanotechnologii.16 Ogólnie rzecz biorąc, zostały one przygotowane przy użyciu polimerów semitelechelicznych posiadających jedną funkcjonalną grupę końcową, która może być wykorzystana do koniugacji bezpośrednio lub po modyfikacjach chemicznych.1 Podczas gdy wprowadzenie technik kontrolowanej polimeryzacji rodnikowej (CRP) do dziedziny biokoniugacji umożliwiło syntezę biokoniugatów polimerów17 jak również bezpośrednią syntezę dobrze zdefiniowanych polimerów semitelechelicznych odpowiednich do koniugacji z biomolekułami bez potrzeby modyfikacji po polimeryzacji,18,19 przyniosły również możliwość jednoetapowej syntezy dobrze zdefiniowanych polimerów telechelicznych. Jest to możliwe dzięki temu, że sfunkcjonalizowany czynnik RAFT pozostaje na końcu łańcucha po polimeryzacji. Wykorzystując tę nieodłączną funkcjonalność grupy końcowej, RAFT umożliwia syntezę różnych dobrze zdefiniowanych polimerów do chemoselektywnego sprzęgania z biomolekułami. Udowodniono, że polimery z końcowymi grupami funkcyjnymi kwasu karboksylowego, azydku, aminy i tiolu nadają się do selektywnego biokoniugowania.1 Polimery zsyntetyzowane metodą RAFT z końcowymi grupami kwasu karboksylowego zostały z powodzeniem biokoniugowane z biotyną i biotyną PEGylowaną.20 Podobnie, polimer funkcjonalizowany aminą został z powodzeniem sprzężony z aktywowanym związkiem fluorescencyjnym, estrem N-hydroksysukcynoimidowym kwasu 6-[fluoresceiny-5(6)-karboksyamido] heksanowego (5-SFX) (Sigma Product No. 46940). Można sobie łatwo wyobrazić, że takie techniki mogą być stosowane do produkcji biokoniugatów, takich jak peptydy, białka lub cząsteczki celujące do dostarczania leków lub genów.
Polimery RAFT zawierające azydek i tiol nadawały się do koniugacji z biomolekułami przy użyciu "chemii kliknięć"."21 Li i współpracownicy21zaadoptowali katalizowaną miedzią azydkowo-alkilową chemię kliknięć do syntezy reagujących koniugatów białko-polimer, jak pokazano na Rysunku 2. W ich badaniu BSA został sfunkcjonalizowany grupą alkinową poprzez reakcję wolnej reszty cysteinowej z maleimidem propargilu. Zakończony azydkiem poli(NIPAAm) został przygotowany za pomocą RAFT, a sprzężenie białko-polimer zostało osiągnięte poprzez cykloaddycję azydek-alkin katalizowaną miedzią (Rysunek 2).

Rysunek 2.Polimery wytworzone metodą RAFT i sfunkcjonalizowane azydkiem zdolnym do klikania mogą być stosowane do tworzenia biokoniugatów polimer-białko.
W ostatnich latach wiele reakcji opartych na tiolach zostało uznanych i wykorzystanych jako wysoce wydajne procesy syntezy i funkcjonalizacji polimerów.22 Rosnąca liczba dostępnych dróg przekształcania końcowej grupy tiokarbonylotio w tiol zapewnia możliwość badania i wykorzystywania chemii na funkcjonalnym "uchwycie" tiolu.Przykłady reakcji, które można przeprowadzić na końcowej grupie tiolowej w (ko)polimerach przygotowanych metodą RAFT obejmują reakcje tiol-en, tiol-yne, tiol-izocyjanian, tiol-halo i tiol-oksiran, z których wiele posiada kluczowe cechy reakcji typu click.22
Opracowaliśmy szeroką gamę funkcjonalnych polimerów o precyzyjnej masie cząsteczkowej i wąskiej polidyspersyjności (PDI <1.1), z których wiele jest funkcjonalizowanych kwasem karboksylowym, azydkiem, aminą i grupami tiolowymi. Są one powszechnie stosowane jako prekursory do syntezy pożądanych kopolimerów blokowych do potencjalnych zastosowań biomedycznych.
Amfifilowe kopolimery i samoorganizacja
Samoorganizacja amfifilowych kopolimerów di- i trójblokowych w micele i pęcherzyki (polimersomy) była szeroko badana w zastosowaniach farmaceutycznych, począwszy od technologii przedłużonego uwalniania do dostarczania genów.23-26 Cząsteczki terapeutyczne mogą być włączane do miceli i pęcherzyków poprzez oddziaływania hydrofobowe, przyciąganie elektrostatyczne, wodór i/lub wiązania kowalencyjne. Biodystrybucję, stabilność, rozpuszczalność, immunogenność i niespecyficzną bioaktywność terapeutyków można zmieniać za pomocą miceli/pęcherzyków racjonalnie zaprojektowanych do konkretnego zastosowania.20,26-27 Struktury micelarne można zaprogramować tak, aby uwalniały terapeutyki pod wpływem czynników środowiskowych, takich jak temperatura i pH lub poprzez bierną dyfuzję, w zależności od zastosowania.28 Ogromną uwagę w dziedzinie polimeryzacji RAFT poświęcono generowaniu amfifilowych kopolimerów blokowych jako bloków budulcowych miceli/pęcherzyków do potencjalnych zastosowań w dostarczaniu leków. Polimeryzacja RAFT zapewnia wszechstronną drogę do generowania miceli kopolimerów blokowych o kontrolowanych cechach, takich jak długości bloków wpływające na krytyczne stężenie miceli (a tym samym stabilność), rozmiar hydrodynamiczny i morfologię oraz funkcje chemiczne w koronie i rdzeniu miceli, oferujące możliwości stabilizacji struktury supramolekularnej poprzez wiązania kowalencyjne (tj. sieciowanie powłoki lub rdzenia), koniugację z biologicznie aktywnymi cząsteczkami, takimi jak cząsteczki celujące specyficzne dla komórek i terapeutyki. Opracowaliśmy serię dobrze zdefiniowanych amfifilowych kopolimerów polistyren-blok-poli(kwas akrylowy) (PS-blok-PAA) przy użyciu polimeryzacji RAFT (Rysunek 3). Otrzymane kopolimery wykazują kontrolowaną masę cząsteczkową, jak również wąskie wskaźniki polidyspersyjności (PDI <1.2) (Tabela 1). Grupa końcowa tioestru, czynnika RAFT, została usunięta przez redukcję indukowaną rodnikiem w celu uzyskania bezbarwnych, nietoksycznych polimerów.
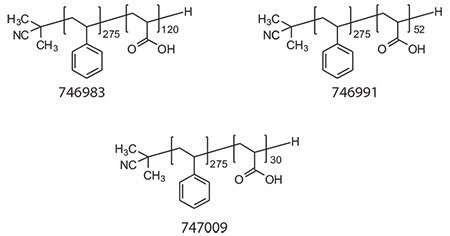
Rysunek 3.Struktury PS-blok-PAA z zawartością PAA odpowiednio 30%, 15% i 10%.
Mikelizacja kopolimerów blokowych polistyren-blok-poli(kwas akrylowy)
Mikelizacja kopolimerów blokowych, zwłaszcza tych składających się z PS-blok-PAA, była szeroko badana.29 Stwierdzono, że na morfologie ma wpływ wiele zmiennych, w tym skład kopolimerów blokowych, masa cząsteczkowa, stężenie kopolimeru i rodzaj wspólnego rozpuszczalnika.
Przegląd morfologiczny i charakterystykę molekularną PS-block-PAA przedstawiono w Tabeli 1. Ogólnie rzecz biorąc, micele o średnicy ~30 nm i pęcherzyki o średnicy 75-300 nm można uzyskać po prostu zmieniając skład bloku i masę cząsteczkową polimerów.
.
| PS-block-PAA | Mole % PAA | Mn (kDa) | Morfologia | Średnica (nm) |
|---|---|---|---|---|
| 197-b-47 | 19 | 24 | Micele | 20 |
| 132-b-61 | 32 | 18 | Micelles | 26 |
| 130-b-120 | 48 | 22 | Micelles | 28 |
| 120-b-120 | 50 | 21 | Micelles | 37 (usieciowane) |
| 248-b-47 | 16 | 30 | Pęcherzyk | 75 |
| 40-b-40 | 50 | 7 | Micele | 80 (usieciowane) |
| 188-b-34 | 15 | 22 | Pęcherzyk | 86 |
| 310-b-28 | 8 | 34 | Vesicle | 90 |
| 300-b-44 | 13 | 35 | Vesicle | 90 |
| 275-b-47 | 15 | 32 | Vesicle | 100 |
| 310-b-52 | 14 | 36 | Vesicle | 100 |
| 132-b-26 | 17 | 16 | Pęcherzyki | 100 |
| 310-b-36 | 10 | 35 | Vesicle | 125 |
| 434-b-47 | 10 | 49 | Vesicle | 292 |
Badaliśmy micelizację trzech kopolimerów PS-block-PAA o zawartości PAA 30%, 15% i 10% (Tabela 2) metodą dynamicznego rozpraszania światła (DLS).
| PS-block-PAA | Mole % PAA | Mn | Mw/Mn (PDI) | Morfologia | Rh (nm) |
|---|---|---|---|---|---|
| 275-b-120 | 30 | 37,000 | 1.15 | Micelles | 30-50 |
| 275-b-52 | 15 | 32,000 | 1.17 | Pęcherzyki | ~100 |
| 275-b-30 | 10 | 31,000 | 1.14 | Pęcherzyki | ~300 |
Micele/pęcherzyki przygotowano w 1% mas. roztworze polimeru w 1,4-dioksanie z dodatkiem 20% wody (v/v). Dane DLS pokazują, że rozmiar miceli/pęcherzyków wzrasta wraz ze spadkiem zawartości PAA (Tabela 2). Wynika to ze wzrostu zawartości hydrofobowej i silnego oddziaływania hydrofobowego bloku PS w wodzie. Zdolność do kontrolowania wielkości miceli/pęcherzyków utworzonych przy użyciu odpowiedniego kopolimeru blokowego umożliwia dalsze badania w interesujących zastosowaniach, takich jak aktywne ładowanie leków i kontrolowane uwalnianie w zastosowaniach biomedycznych.
Wnioski
Polimery RAFT są coraz częściej wykorzystywane w potencjalnych zastosowaniach związanych z dostarczaniem leków. Potencjalną toksyczność grup tiokarbonylotio można łatwo wyeliminować poprzez obróbkę polimeryzacyjną polimerów RAFT.30 Jednakże, wyniki testów toksyczności określone w kilku opublikowanych badaniach31 sugerują, że usunięcie aktywnej funkcjonalności tiokarbonylotio z polimerów syntetyzowanych metodą RAFT może nie zawsze być konieczne do dostarczania leków.w badaniach in vitro w zależności od rodzaju czynnika RAFT (grupy podstawników), rodzaju polimeru i komórek oraz stężenia użytego polimeru. Podczas gdy systematyczne badania nad profilem farmakologicznym, takim jak cytotoksyczność metaboliczna, polimerowych czynników RAFT nie zostały jeszcze przeprowadzone, rosnąca popularność w literaturze wskazuje, że coraz więcej polimerów RAFT jest stosowanych w dziedzinie kontrolowanego dostarczania leków przez chemików polimerów, materiałoznawców i badaczy biomedycznych. Komercyjna dostępność czynników RAFT i polimerów RAFT będzie nadal zwiększać ich zastosowanie w przemyśle.
Network error: Failed to fetch
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.