Metoda LC/MS/MS oznaczania glifosatu, AMPA i glufosynatu w zbożach
Wprowadzenie
Glifosat jest jednym z najczęściej stosowanych herbicydów na świecie. Jego użycie znacznie wzrosło po wprowadzeniu genetycznie zmodyfikowanych upraw tolerujących glifosat, takich jak kukurydza, soja i bawełna. Obecnie na polach stosuje się ponad 1,4 miliarda funtów glifosatu rocznie.1 Dokument regulacyjny US EPA CFR - tytuł 40 - tom 24 określa poziomy tolerancji dla występowania glifosatu w produktach spożywczych i produktach.2
Poziomy tolerancji EPA dla pozostałości glifosatu w ziarnach zbóż (zwanych również grupą upraw 15) są ustalone na 30 ppm. Nie dotyczy to ryżu, soi i kukurydzy. W przypadku ryżu tolerancja wynosi 0,1 ppm, podczas gdy w przypadku kukurydzy cukrowej jest to 3,5 ppm.2 W przypadku glufosynatu, herbicydu, który jest często uwzględniany z glifosatem w metodach analitycznych, wartości tolerancji wynoszą 0,4 ppm dla ziaren zbóż i 1,0 ppm dla ryżu. Te wartości tolerancji obejmują metabolity i degradanty. Dlatego też metabolit glifosatu (kwas aminometylo)-fosfonowy (AMPA) został również uwzględniony w tym badaniu (Rysunek 1).

Rysunek 1. Struktury glifosatu, AMPA i glufosynatu
Ponieważ glifosat jest szeroko stosowany w produkcji soi i kukurydzy, spodziewano się, że zostanie znaleziony w tych towarach. W tej aplikacji skupiliśmy się na badaniu obecności glifosatu w innych zbożach (owies i pszenica) wykorzystywanych do produkcji płatków śniadaniowych, w tym produktów zbożowych dla niemowląt.
W ciągu ostatnich 30 lat opracowano różne metody analizy glifosatu. Niektóre z nich wymagały derywatyzacji analitów do HPLC z detekcją fluorescencyjną z o-ftaldehydem.3 Metoda derywatyzacji glifosatu przy użyciu chlorku fluorenylometyloksykarbonylu (FMOC) i detekcji fluorescencyjnej została zaproponowana i jest stosowana przez niektóre laboratoria.4 Ostatnio, wraz z pojawieniem się nowoczesnych, bardziej czułych i wytrzymałych instrumentów LC/MS/MS, możliwe stało się analizowanie glifosatu i jego metabolitów bez derywatyzacji. W tej pracy wykorzystaliśmy bezpośrednią analizę glifosatu metodą MS/MS.
Eksperymentalne
W celu potwierdzenia skuteczności metody wykorzystano organiczne błyskawiczne płatki owsiane i organiczną mąkę pełnoziarnistą. Żywność ta została przeskanowana pod kątem obecności glifosatu i nie stwierdzono jego obecności. Mąka pełnoziarnista została użyta bez zmian, a płatki owsiane błyskawiczne zostały zmielone przed użyciem. W celu zbadania wydajności metody, obie matryce zostały wzbogacone w 100 ppb glifosatu i 100 ppb glufosynatu.
Owies został również wzbogacony w 100 ppb AMPA. Ekologiczna mąka kukurydziana została również zakupiona i przetestowana na obecność glifosatu i okazała się wolna od glifosatu. Ta sama metodologia może być również stosowana do testowania mąki kukurydzianej i produktów kukurydzianych.
Do badań przesiewowych, następujące matryce wykorzystały opracowane metody i zostały przetestowane na obecność glifosatu: biała mąka, płatki owsiane błyskawiczne, płatki ryżowe dla niemowląt, płatki owsiane dla niemowląt i mieszane płatki zbożowe dla niemowląt.
Obróbka wstępna
Metoda ekstrakcji opierała się na metodologii QuPPe (Quick Polar Pesticides Method) opracowanej w Unii Europejskiej (UE) dla owoców i warzyw i wykorzystywała wodę:metanol (50:50) zawierający kwas mrówkowy jako końcowy rozpuszczalnik ekstrakcyjny.5 Pięciogramową próbkę homogenizowanego ziarna lub zboża odważono do 50 ml probówki wirówkowej. Dodano wodę (10 ml) i 100 μl roztworu wzorca wewnętrznego (20 μg/ml każdego analitu w wodzie). Następnie próbki pozostawiono na 30 minut do dwóch godzin. Następnie dodano 10 ml metanolu zawierającego 1% v/v kwasu mrówkowego. Próbki mieszano przez 15 minut w wytrząsarce laboratoryjnej i odwirowano. Dwie próbki użyte podczas walidacji, owies i pszenica, dały znacząco różne ekstrakty. Podczas gdy owies dawał klarowny, żółty ekstrakt, ekstrakt pszenicy był mętny i trudny do przefiltrowania. W rezultacie zastosowano dwie różne procedury oczyszczania próbek dla różnych próbek ziarna.
Oczyszczanie próbek za pomocą SPE
W przypadku próbek, które nie zawierały cząstek stałych po ekstrakcji i odwirowaniu, zastosowano ekstrakcję do fazy stałej (SPE) przy użyciu wkładu Supel™- Select HLB, podobnie jak w metodzie opisanej przez Chamkasema i Harmona.6 Wkłady HLB kondycjonowano przy użyciu 100% metanolu, a następnie wody:metanolu (50:50) zawierającego 0,5% v/v kwasu mrówkowego. W przypadku wkładów SPE o pojemności 1 ml do dalszego kondycjonowania wkładu użyto 0,5 ml ekstraktu próbki. Eluat z tego etapu kondycjonowania został odrzucony. Druga porcja ekstraktu próbki (0,5 ml) została załadowana do wkładu HLB. Ten eluat został zebrany i przefiltrowany przez fiolki z filtrem polipropylenowym o grubości 0,2 mikrona.
Oczyszczanie próbek za pomocą ultrafiltracji
Urządzenia do ultrafiltracji zostały użyte do oczyszczania ekstraktów próbek, takich jak pszenica, które zawierały cząstki stałe po etapie wirowania. W niniejszej pracy zastosowano membrany polieterosulfonowe o masie cząsteczkowej 3 kDa (MWCO). Membrany zostały wstępnie kondycjonowane przez przepuszczenie 0,5 ml rozpuszczalnika ekstrakcyjnego przez wirowanie przy 4000 obr/min przez 5 minut w celu utrzymania stałego czasu retencji glifosatu. Ten przelotowy rozpuszczalnik został odrzucony i załadowano 1 ml ekstraktu próbki. Etap ultrafiltracji przeprowadzono przez wirowanie przez 45 minut przy 4000 obr. Ustalono również, że urządzenia do ultrafiltracji zawierające membranę z regenerowanej celulozy, takie jak filtry odśrodkowe Amicon™ Ultra o MWCO 3 kDa, mogą być stosowane na tym etapie bez wstępnego przygotowania. Przejrzysta próbka, która przeszła przez membranę została zebrana i poddana analizie. Do analizy użyto fiolek o niskiej absorpcji, aby zapobiec utracie analitów na powierzchni szkła.
Przygotowanie próbek piwa
Próbki piwa można analizować przy użyciu tej samej metodologii. Najpierw przeprowadzono dokładne odgazowanie piwa, umieszczając próbkę piwa w łaźni ultradźwiękowej na 15 minut. Następnie 5 ml próbki piwa zmieszano z 5 ml metanolu z 1% kwasem mrówkowym i wzorcem wewnętrznym. Próbka ta została krótko wymieszana i oczyszczona przy użyciu procedury SPE.
Metoda LC/MS/MS
Kolumna HPLC użyta do tej analizy była oparta na polimerze apHera™ NH2 kolumna, która zapewnia stabilne i solidne separacje LC od pH 2 do 13. Gradient fazy ruchomej wykorzystywał wodę i węglan amonu przy pH 9. Ta faza ruchoma zapewniała właściwą jonizację glifosatu, który ma w swojej strukturze grupę fosforanową, z detekcją w ujemnych warunkach ESI. Ponadto bufor węglanu amonu jest lotny i w pełni kompatybilny z oprzyrządowaniem LC/MS. Tabela 1 zawiera warunki MS dla wszystkich analitów, a Rysunek 2 przedstawia chromatogram standardowego wstrzyknięcia. Analizę przeprowadzono przy użyciu urządzenia AB Sciex QTrap 3200. To ograniczyło czułość metody. Jednak, jak widać poniżej, metoda była w stanie określić ilościowo zanieczyszczenie glifosatem w większości próbek w tym badaniu.
| Związek | Q1 | Q3 | DP | EP | |
|---|---|---|---|---|---|
| Glifosat | Quant | 167.8 | 63 | -30 | -5.5 |
| Qual | 167.8 | 79 | -30 | -5.5 | |
| Glifosat-2-13C,15N AMPA | Quant | 19.8 | 62.9 | -30 | -4.5 |
| Quant | 110 | 63 | -45 | -10 | |
| Qual | 110 | 81 | -40 | -10 | |
| AMPA-13C,15N,D2 Glufosynat | Quant | 113.9 | 63 | -40 | -5 |
| Quant | 180 | 63 | -35 | -6 | |
| Qual | 180 | 136 | -40 | -4 | |
| Glufosynat-D3 | Quant | 182.9 | 63 | -30 | -7.5 |
Wyniki
Wydajność metody
Obydwie metody oczyszczania SPE i ultrafiltracji zapewniły dobre oczyszczenie próbki i były akceptowalne dla analizy LC/MS. W płatkach owsianych wszystkie trzy anality zostały wykryte i oznaczone ilościowo na poziomie 100 ppb. W mące pszennej glifosat i glufosynat oznaczono ilościowo na poziomie 100 ppb. Wyniki testów metod przedstawiono w Tabeli 2. Metoda dla próbek pszenicy dała nieco wyższe niepewności, do 19% RSD. W metodzie dla pszenicy nie zastosowano oczyszczania SPE, a uzyskane sygnały miały wyższe tłumienie jonów w porównaniu z próbkami oczyszczonymi za pomocą SPE, takimi jak owies. Ogólnie rzecz biorąc, we wszystkich próbkach występowały różne stopnie tłumienia jonów, od 50% do 80%, dlatego ważne było zastosowanie wzorców wewnętrznych w celu dokładnego oznaczenia ilościowego.
| Analit/Matryca | Glifosat | AMPA | Glufosynat | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N=6 | Odzysk (%) | RSD (%) | Odzyskiwanie (%) | RSD (%) | Odzyskiwanie (%) | RSD (%) | |||
| Oatmeal | 125 | 5 | 118 | 15 | 105 | 5 | |||
| Whole wheat | 125 | 19 | - | - | 105 | 16 | |||
| Beer | 118 | 21 | - | - | 112 | 7 | |||
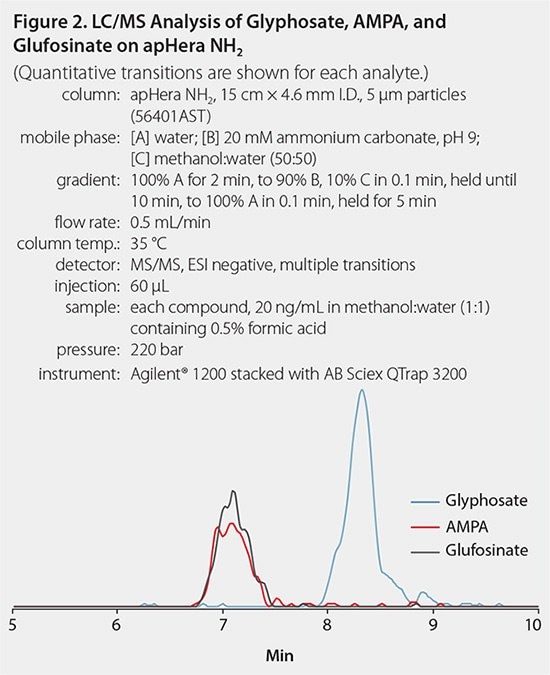
Rysunek 2.Analiza LC/MC glifostatu, AMPA i glufosynatu na apHera NH2
Glifosat w piwie
W badanym piwie nie znaleziono żadnych analitów. W związku z tym próbka piwa została wzbogacona glifosatem i glufosynatem w stężeniu 50 ppb i poddana analizie. Wyniki przedstawiono w Tabeli 2.
Identyfikacja i oznaczanie ilościowe glifosatu w zbożach
Wyniki oznaczania ilościowego glifosatu w zbożach przedstawiono w Tabeli 3. Próbki błyskawicznych płatków owsianych (Rysunek 3) i białej mąki zawierały znaczne ilości glifosatu, odpowiednio 1,2 i 0,8 ppm. Próbka organicznych płatków owsianych nie zawierała wykrywalnych ilości glifosatu (Rysunek 4). Płatki ryżowe dla niemowląt miały bardzo niski poziom glifosatu. Poziomy były zbliżone do granicy czułości przyrządu, ponieważ matryca i wynikające z niej RSD były wysokie. Zboża owsiane dla niemowląt zawierały glifosat na poziomie 1,1 ppm, a mieszane zboża dla niemowląt zawierały glifosat na poziomie 0,25 ppm. Żadne ze zbóż dla niemowląt nie było oznaczone jako organiczne. Glufosynat nie został znaleziony w żadnych produktach zbożowych. AMPA znaleziono tylko w błyskawicznych płatkach owsianych na niskim poziomie.
| Analyte/Matrix | Glyphosate | AMPA | Glufosynat | ||
|---|---|---|---|---|---|
| N=3 | Znaleziono, ppm | % RSD | Znaleziono, ppm | % RSD | Znaleziono, ppm |
| Oatmeal | 1.2 | 8 | 0.04 | 27 | ND |
| Mąka pszenna biała | 0.8 | 12 | NT | - | ND |
| Mąka ryżowa dla niemowląt | 0.06 | 12 | ND | - | ND |
| Płatki owsiane dla niemowląt | 1.1 | 4 | NT | - | ND |
| Mieszane płatki śniadaniowe dla niemowląt | 0.25 | 5 | NT | - | ND |
| Piwo (Lager) | ND | - | ND | - | ND |

Rysunek 3. Glifosat w trybie natychmiastowym

Rysunek 4.Próbka organicznej mąki owsianej, ślepa próba i domieszka 100ppb glifosatu
Wnioski
Proponowana metoda opracowana dla glifosatu i związków pokrewnych wykorzystuje detekcję LC/MS/MS oraz kolumnę apHera NH2 opartą na polimerze jonowymiennym, która jest stabilna w warunkach wyższego pH. Metodologia przygotowania próbek została opracowana w celu ekstrakcji glifosatu ze zbożowych produktów spożywczych. Metodologia ta obejmowała oczyszczanie przy użyciu polimerowej SPE, którą z powodzeniem zastosowano do próbek zbóż, w tym płatków owsianych i produktów zbożowych dla niemowląt. Oczyszczanie obejmujące ultrafiltrację zostało opracowane dla produktów zawierających pszenicę i zostało z powodzeniem zastosowane do próbek mąki pszennej. Zastosowanie izotopowo znakowanych wzorców skutkowało lepszą dokładnością oznaczania glifosatu i pozwoliło na wykorzystanie krzywych kalibracyjnych opartych na rozpuszczalnikach poprzez kompensację efektów jonizacji obecnych w próbkach. Metoda okazała się wytrzymała i działała dobrze, nawet gdy była stosowana na starszym i mniej czułym oprzyrządowaniu.
Network error: Failed to fetch
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?Dla wygody naszych klientów ta strona została przetłumaczona maszynowo. Dołożyliśmy starań, aby zapewnić dokładne tłumaczenie maszynowe. Tłumaczenie maszynowe nie jest jednak doskonałe. Jeśli tłumaczenie maszynowe nie spełnia Twoich oczekiwań, przejdź do wersji w języku angielskim.